北京理工大学谢海燕教授课题组在Advanced Materials杂志(影响因子27.398)上发表文章,报道了一种工程化自激活的光-EVs,并将其用于协同三模态抗癌治疗。
细胞外囊泡(EVs)在疾病治疗和药物递送方面都具有巨大潜力。然而,准确地从EV释放药物,以及EV和药物在目标组织处的自发治疗配合仍然是挑战。该研究报道了一种工程化的可自我激活的光-EV,用于协同三模态抗癌治疗。M1巨噬细胞衍生的EVs(M1 EVs)同时装有双[2,4,5-三氯-6-(戊氧羰基)苯基]草酸酯(CPPO)、Ce6和前药Dox-EMCH。给药后,由于M1 EVs的肿瘤归巢能力,该系统可主动靶向肿瘤细胞,其中M1 EVs将M2重新极化为M1巨噬细胞,不仅显示出免疫疗法的作用,而且还产生H2O2。H2O2和CPPO之间的反应产生化学能,激活Ce6,产生用于成像的化学发光和用于光动力疗法(PDT)的单线态氧(1O2)。同时,由O2引起的膜破裂导致Dox-EMCH释放,Dox-EMCH随后被激活并穿透肿瘤的低氧区域。免疫疗法、PDT和化学疗法的协同作用可产生有效的抗癌功效,显示出抗击癌症的巨大希望。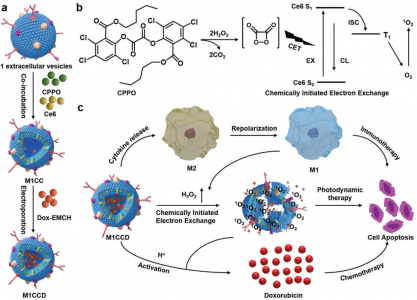
使用M1巨噬细胞衍生的载药EVs(M1CCD)进行三模态抗癌治疗的示意图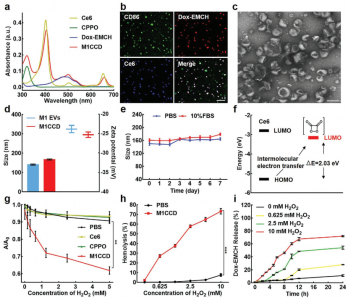
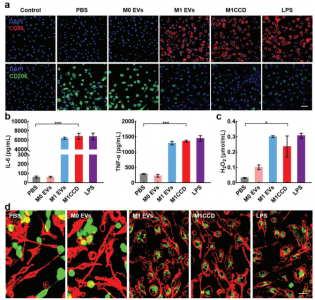
M1CCD可以有效地将M2巨噬细胞重新极化为M1表型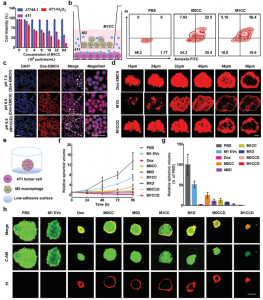
M1 EVs中的CPPO和Ce6执行有效的PDT作用并促进Dox-EMCH的释放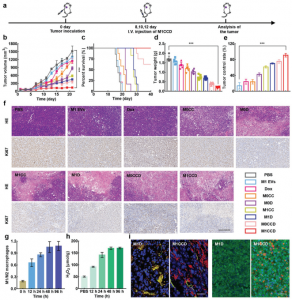
Ding,J., et al. (2021). "Self-Activatable Photo-Extracellular Vesicle forSynergistic Trimodal Anticancer Therapy." Advanced Materials:e2005562.外泌体资讯网 【Advanced Materials】北理工谢海燕组:自激活的光-胞外囊泡用于协同三模态抗癌治疗