外泌体miRNA是一种新型的内分泌因子,发挥着重要的病理和生理作用。来自南京大学生命科学学院、南京鼓楼医院张辰宇课题组的研究人员发现,病理或生理条件触发的高水平游离脂肪酸刺激胰腺β细胞分泌含miR-29s的外泌体,并进入体循环,这些外泌体主要传递到了肝脏并抑制胰岛素的敏感性。该研究发表于近期的Journal of Extracellular Vesicles杂志上。
外泌体中的小RNA(miRNA)被认为是细胞间通讯的一种形式,并且在过去十年中受到越来越多的关注。miRNA是一类由19-22个核苷酸组成的单链非编码RNA,在转录后水平上负调节基因表达。权威观点认为,miRNA是在细胞内产生并发挥其功能的。但是,越来越多的证据表明,细胞中的miRNA可以包装在外泌体中并释放到循环系统中。与其他细胞因子一样,外泌体miRNA并非被动释放,而是响应特定刺激下的选择性分泌,这表明miRNA的分泌可能与体内特定的生理或病理过程有关。
外泌体是一种细胞外囊泡(EV),直径为30-150 nm的膜结合囊泡。外泌体miRNA可以通过外泌体运输转移到受体细胞中。这些miRNA在细胞内部调节靶基因的表达并调节生物学功能。外泌体miRNA参与多种病理过程,包括肿瘤血管生成、癌症中的免疫逃逸、动脉粥样硬化和代谢异常。在过去的十年中,人们对由外泌体miRNA介导的代谢器官之间的联系越来越感兴趣,其中,外泌体miRNA已成为促进代谢动态平衡网络调节的内分泌因子。已经阐明了几种外泌体miRNA介导的器官间通信,包括由miR-27a / miR-130b / miR-155介导的脂肪组织与骨骼肌间的联系、通过外泌体miR-99b进行的棕色脂肪组织与肝脏之间的联系以及通过miR-194/miR‐410‐5p进行的脂肪组织与心血管系统之间的联系。然而,外泌体miRNA的功能作用仍远未得到很好的理解。因此,从其他器官释放的外泌体miRNA及其在受体器官中的功能作用值得进一步研究。
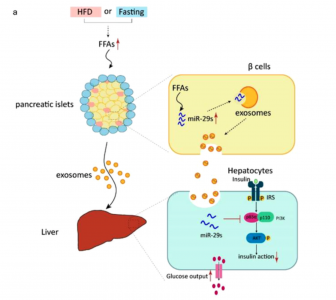
胰腺是内分泌器官,在调节葡萄糖稳态中起着关键作用。胰腺中的内分泌细胞聚集并形成胰岛,通过释放各种激素来维持葡萄糖稳态。胰岛β细胞和α细胞分别释放的胰岛素和胰高血糖素,二者在肝脏、脂肪组织和骨骼肌等其他周围器官中通过相反的调节产生平衡作用,实现葡萄糖稳态调控。因此,胰腺和其他器官之间的相互作用形成了一个调节网络,该调节网络通过分泌因子来调节葡萄糖稳态。鉴于外泌体miRNA充当内分泌因子,研究人员猜想,胰岛分泌的外泌体/外泌体miRNA是否会介导胰腺和周围器官的通信。
考虑到葡萄糖稳态中的调节作用,研究人员选择了高水平的游离脂肪酸(FFA)作为刺激物。首先,FFA通过与β细胞中的G蛋白偶联受体(GPCR)结合并相互作用来调节生理和病理条件下的胰岛素释放。其次,FFA水平的变化会导致代谢状况发生重大变化。血浆FFA水平升高可增强健康受试者和T2D患者的糖异生。病理性肥胖相关的FFA通过抑制胰岛素介导的糖异生作用而促进肝胰岛素抵抗。相反,在T2D患者或肥胖受试者中降低FFA浓度可改善胰岛素敏感性,并减少内源性葡萄糖生成(EGP)。因此,本研究拟揭示胰腺胰岛中外泌体miRNA的分泌,以响应高水平的FFA以及外泌体miRNA在葡萄糖稳态中的功能作用。
在这项研究里,研究人员发现胰腺β细胞释放的外泌体miR-29家族成员(miR-29s)调节肝胰岛素敏感性并控制葡萄糖稳态。在体外,高水平FFA培养的胰岛分泌miR-29s。在体内,高脂饮食(HFD)喂养(生理病理学)或禁食(生理学)促进FFA含量,增加了miR-29s向血浆的分泌。静脉内注射miR-29s可降低胰岛素敏感性。转基因(TG)小鼠β细胞中miR-29s的过表达促进了miR-29s的分泌,并抑制了胰岛素介导的肝脏对葡萄糖输出的抑制。研究人员选择性过表达β细胞中的异源突变体miR-29s证实胰岛来源的外泌体miR-29s靶向肝脏中的胰岛素信号传导并调节胰岛素敏感性。此外,体内β细胞中miR-29s表达的破坏逆转了HFD诱导的胰岛素抵抗。体外实验表明,富含miR-29s的外泌体抑制了肝脏中的胰岛素信号传导并增加了肝葡萄糖的产生。这些结果揭示了一种新的β细胞源性分泌信号——外泌体miR-29s,并揭示了miR-29s在操纵葡萄糖稳态中的作用。