红细胞是人体的生命线,但它们也是世界上最致命的生物之一——疟原虫——的理想寄主。在感染人体约两周后,恶性疟原虫开始入侵红细胞,迅速占领了红细胞的内部。然后,疟疾开始危及生命,尤其是对儿童——每天约有1000人死于这种疾病。在“以色列科技研发大脑”魏茨曼科学研究所,两个研究团队联合揭示了疟原虫能够进行如此有效侵略红细胞的原因。
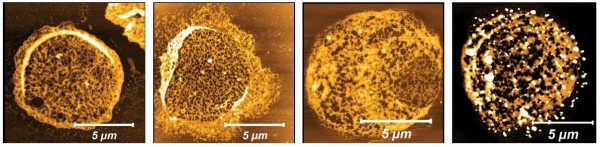 图1:用原子力显微镜观察红细胞的细胞骨架。与对照组(左一和左二)相反,在疟原虫释放的细胞外囊泡的暴露下会导致细胞骨架融解(黄色,右二)或出现孔洞(黑色,右一)。Neta Regev-Rudzki博士及其在生物分子科学系的团队发现,恶性疟原虫寄生虫释放出微小的囊状“包裹”,称为细胞外囊泡,其中包含了奇特的货物——一种称为蛋白酶体的细胞蛋白质降解机器,蛋白酶体通常会分解错误折叠或不需要的蛋白质。Michal Sharon教授专门研究蛋白酶体,他的团队建议两个实验室联合,结合他们的专业知识,找出这些蛋白酶体在疟疾包装中的作用。这项联合研究由Regev-Rudzki实验室的博士生Elya Dekel和Sharon实验室的博士后研究员Dana Yaffe博士主导,他们发现了一种特殊的策略,疟原虫可以利用蛋白酶体实现其自身目的,即触发红细胞为即将到来的细胞入侵做准备。此准备步骤可帮助数以千计的寄生虫在几秒钟内入侵大量红细胞。红细胞具有独特的特性,成为恶性疟原虫特别有吸引力的宿主。首先,它们在成熟时会失去大部分细胞器,这意味着它们缺乏防御寄生虫的能力。其次,这些细胞能够通过最小的血管横截面,从而将氧气输送到人体所有组织,这意味着它们拥有庞大的细胞内环境可以重塑:寄生虫将其转化为优势。通过蚊虫叮咬进入人体后,恶性疟原虫在肝脏中呆了两个星期左右后,然后进入复杂生命周期的下一阶段并成倍增长。然后疟原虫进入血液,侵入一些成熟的红细胞。这些疟原虫释放出封装了蛋白酶体的囊泡,去软化邻近的红细胞膜,使其更易于被渗透。此准备步骤可帮助数以千计的寄生虫在几秒钟内侵入大量细胞。研究人员设法揭露了疟原虫入侵前的更多细节。他们确定,疟原虫的细胞外囊泡含有一种称为20S的蛋白酶体。这个过程消耗很少的能量。化学研究支持部的Irit Rosenhek-Goldian博士和Sidney R. Cohen博士合作,开发了一种基于原子力显微镜的特殊可视化技术,他们发现20S蛋白酶体会在红细胞的细胞骨架中戳孔,并溶解细胞骨架中的微丝。研究人员鉴定了四种被该蛋白酶体降解的红细胞蛋白。他们还开发了一种机器学习算法,该算法可将已被分泌的20S改变的红细胞的细胞骨架与尚未被20S影响的细胞骨架区分开。 最后,为了确认蛋白酶体确实产生了红细胞的软化,科学家在用疟原虫的细胞外囊泡处理红细胞之前,先用抑制剂封闭了20S的活性位点。抑制剂阻止了细胞膜的软化,限制了疟原虫对细胞的入侵,从而限制了疟原虫的生长。图2:环状疟原虫感染红细胞的示意图,释放出含有桶形20S蛋白酶体的细胞外囊泡。最后的结果为寻找疟疾疗法开辟了新的方向:防止疟原虫的蛋白酶体侵入红细胞。这项研究的发现也可能被证明与其他传染病有关,因为20S蛋白酶体的亚基已经发现在由不同种类的寄生虫释放的细胞外囊泡中,例如引起昏睡的寄生虫和利什曼病的病原体。而且,该结果可能也适用于癌症,因为最近在人类细胞释放的促进肿瘤生长的细胞外囊泡中也检测到了20S蛋白酶体。参考文献:20S proteasomes secreted by themalaria parasite promote its growth. Nat Commun 12(1):1172.
图1:用原子力显微镜观察红细胞的细胞骨架。与对照组(左一和左二)相反,在疟原虫释放的细胞外囊泡的暴露下会导致细胞骨架融解(黄色,右二)或出现孔洞(黑色,右一)。Neta Regev-Rudzki博士及其在生物分子科学系的团队发现,恶性疟原虫寄生虫释放出微小的囊状“包裹”,称为细胞外囊泡,其中包含了奇特的货物——一种称为蛋白酶体的细胞蛋白质降解机器,蛋白酶体通常会分解错误折叠或不需要的蛋白质。Michal Sharon教授专门研究蛋白酶体,他的团队建议两个实验室联合,结合他们的专业知识,找出这些蛋白酶体在疟疾包装中的作用。这项联合研究由Regev-Rudzki实验室的博士生Elya Dekel和Sharon实验室的博士后研究员Dana Yaffe博士主导,他们发现了一种特殊的策略,疟原虫可以利用蛋白酶体实现其自身目的,即触发红细胞为即将到来的细胞入侵做准备。此准备步骤可帮助数以千计的寄生虫在几秒钟内入侵大量红细胞。红细胞具有独特的特性,成为恶性疟原虫特别有吸引力的宿主。首先,它们在成熟时会失去大部分细胞器,这意味着它们缺乏防御寄生虫的能力。其次,这些细胞能够通过最小的血管横截面,从而将氧气输送到人体所有组织,这意味着它们拥有庞大的细胞内环境可以重塑:寄生虫将其转化为优势。通过蚊虫叮咬进入人体后,恶性疟原虫在肝脏中呆了两个星期左右后,然后进入复杂生命周期的下一阶段并成倍增长。然后疟原虫进入血液,侵入一些成熟的红细胞。这些疟原虫释放出封装了蛋白酶体的囊泡,去软化邻近的红细胞膜,使其更易于被渗透。此准备步骤可帮助数以千计的寄生虫在几秒钟内侵入大量细胞。研究人员设法揭露了疟原虫入侵前的更多细节。他们确定,疟原虫的细胞外囊泡含有一种称为20S的蛋白酶体。这个过程消耗很少的能量。化学研究支持部的Irit Rosenhek-Goldian博士和Sidney R. Cohen博士合作,开发了一种基于原子力显微镜的特殊可视化技术,他们发现20S蛋白酶体会在红细胞的细胞骨架中戳孔,并溶解细胞骨架中的微丝。研究人员鉴定了四种被该蛋白酶体降解的红细胞蛋白。他们还开发了一种机器学习算法,该算法可将已被分泌的20S改变的红细胞的细胞骨架与尚未被20S影响的细胞骨架区分开。 最后,为了确认蛋白酶体确实产生了红细胞的软化,科学家在用疟原虫的细胞外囊泡处理红细胞之前,先用抑制剂封闭了20S的活性位点。抑制剂阻止了细胞膜的软化,限制了疟原虫对细胞的入侵,从而限制了疟原虫的生长。图2:环状疟原虫感染红细胞的示意图,释放出含有桶形20S蛋白酶体的细胞外囊泡。最后的结果为寻找疟疾疗法开辟了新的方向:防止疟原虫的蛋白酶体侵入红细胞。这项研究的发现也可能被证明与其他传染病有关,因为20S蛋白酶体的亚基已经发现在由不同种类的寄生虫释放的细胞外囊泡中,例如引起昏睡的寄生虫和利什曼病的病原体。而且,该结果可能也适用于癌症,因为最近在人类细胞释放的促进肿瘤生长的细胞外囊泡中也检测到了20S蛋白酶体。参考文献:20S proteasomes secreted by themalaria parasite promote its growth. Nat Commun 12(1):1172.外泌体资讯网 疟原虫在入侵红细胞前释放含20S蛋白酶体的囊泡 加速感染进程