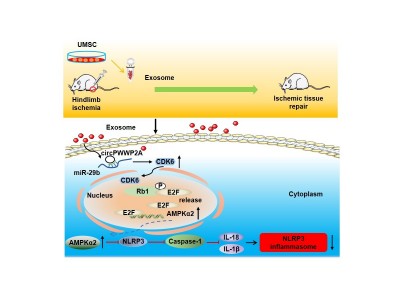
2021年3月17日,苏州大学附属第一医院心血管病研究所的李杨欣教授团队在Signal Transduction and Targeted Therapy(IF=13.493,即时IF=17.32)杂志上在线发表了一篇题为“Stem cell-derivedexosomes repair ischemic muscle injury by inhibiting the tumor suppressorRb1-mediated NLRP3 inflammasome pathway”的文章,表明人脐带间充质干细胞分泌的外泌体能够释放环状RNA cPWWP2A,释放的cPWWP2A进一步参与调控miR-29b/CDK6/Rb1/AMPKα2/NLRP3信号通路,抑制体内的炎症反应并最终修复缺血组织损伤。这项研究不仅发现了调控NLRP3炎症小体的全新治疗靶点,而且为外泌体转化到临床应用提供了一种新的策略。
外周动脉疾病是一种常见的心血管疾病,尤其是急性下肢缺血,不仅威胁患者的肢体健康,而且严重时甚至会导致截肢,大大降低了患者的生活水平。在组织缺血损伤后,会引发损伤部位强烈的炎症反应,IL-1β、IL-18等大量的炎症因子被释放至细胞外,进而募集更多的趋化因子及炎症细胞,级联放大炎症反应,从而加剧组织损伤。因此,探究炎症反应的调控机制一直是重要的科学和临床问题。
这项研究发现,小鼠后肢缺血后,NLRP3炎症小体被大量激活,同时Caspase-1、IL-1β、IL-18等炎症相关因子的表达显著上调。人脐带组织来源的间充质干细胞释放的外泌体中高表达cPWWP2A,外泌体可以释放cPWWP2A至损伤部位,释放的cPWWP2A通过靶向miR-29b,进一步调控CDK6/Rb1/AMPKα2信号通路, 进而抑制缺血环境下NLRP3炎症小体的激活,以及Caspase-1的表达和IL-1β、IL-18的剪切与释放,减少缺血组织中的炎症反应,最终增强后肢血流和运动功能。
李杨欣团队还开发了一种无细胞的外泌体替代疗法来治疗缺血性疾病,他们的研究证实,外泌体可以通过释放cPWWP2A 替代Rb1基因敲除疗法,来治疗血管功能障碍引起的肌肉损伤。因此,本研究不仅发现了调控NLRP3炎症小体的全新治疗靶点,而且为外泌体替代基因敲除疗法,转化到临床应用提供了一种新的策略。
李杨欣团队博士生王燕丽和硕士生谢文萍为该论文第一作者。该研究得到了国家自然科学基金重大研究计划培育项目、国家自然科学基金面上、江苏省双创团队、江苏省重点项目、江苏省六大人才高峰、苏州临床医学专家团队引进项目等研究经费支持。
外泌体资讯网 即时IF=17.32苏州大学李杨欣教授团队:脐带间充质干细胞外泌体环状RNA cPWWP2A修复缺血组织损伤