线粒体成分在细胞外囊泡的存在被越来越多的研究所报道,但是线粒体成分进入细胞外囊泡的调控机制依旧存在很大的空白。线粒体成分如何进入细胞外囊泡,以及在损伤情况下,线粒体成分如何成为游离成分并作为损伤分子模式来诱发先天免疫,我们对这些环节的调控方式还知之甚少。近日,来自加拿大魁北克的研究者发现了线粒体成分进入细胞外囊泡的分子途径,并对其调控及其病理状态下的异常进行了报道。这对我们深入理解线粒体成分的降解和释放,以及在肿瘤、自身免疫病中线粒体成分对疾病的促进作用具有重要意义。相关研究成果以“Selective packaging of mitochondrial proteins intoextracellular vesicles prevents the release of mitochondrial DAMPs”为题,发表在NatureCommunications上。
大多数细胞会分泌一系列细胞外囊泡(EV),这些细胞通过在细胞之间携带蛋白质和核酸来充当通信介质。细胞外囊泡可大致分为两类:多泡小体与质膜融合产生的外泌体以及从质膜直接出芽形成的微囊泡。有趣的是,许多研究已将线粒体蛋白质鉴定为EV的内容物。
线粒体是细胞所必需的细胞器,它可作为代谢的中央枢纽。因此,线粒体调节了包括从细胞能量的产生到细胞凋亡的诱导和细胞分化的许多关键细胞过程。因此,线粒体功能受损对细胞和生物体都有重大影响,线粒体受损会产生有毒的活性氧(ROS),从而加剧线粒体的危害。重要的是,线粒体受损,或线粒体释放N-甲酰基肽和线粒体DNA可以作为损伤相关分子模式(DAMP),激活先天免疫系统。实际上,细胞外囊泡内的线粒体货物和促炎刺激(如暴露于脂多糖(LPS))后某些细胞类型释放的自由线粒体已显示出刺激促炎细胞因子的产生,从而进一步增强了LPS诱导的炎症。
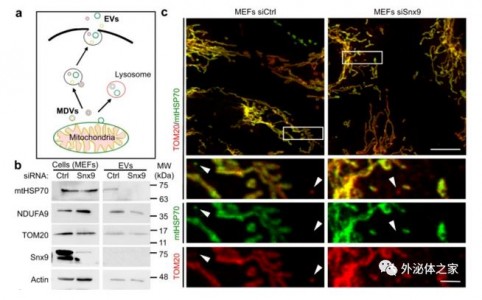
尽管炎症促进了线粒体内容物的分泌,但在不受刺激的条件下,线粒体蛋白也明显存在于细胞外囊泡中。它们分泌的机制以及它们是否也参与免疫激活尚不清楚。在这项研究中,作者证实了细胞选择性地针对溶酶体降解靶向受损的线粒体成分,以防止这种促炎成分释放到细胞外囊泡中。此过程取决于线粒体衍生的囊泡(MDV),即将线粒体蛋白携带到其他细胞器的小囊泡。具体而言,线粒体成分的这种精确分类需要两个不同的MDV途径。将线粒体蛋白递送至细胞外囊泡,首先需要Snx9依赖性的MDV(MDV是先前被证明可调节线粒体抗原呈递的MDV的亚群)。其次,携带受损线粒体成分的MDV的目标不再是溶酶体降解,而是向细胞外释放(这一过程取决于Parkin蛋白的调控)。细胞外囊泡携带线粒体成分释放到胞外和线粒体成分运送到溶酶体降解共享了第一步途径,即Snx9依赖性的MDV运输。在活性氧(ROS)刺激下,相关通路出现异常,会造成线粒体成分进入细胞外囊泡或溶酶体受阻。总而言之,作者的研究结果表明,细胞可以选择性地调节线粒体蛋白在细胞外囊泡中的包装,以防止受损成分的游离释放,避免受损成分在游离到细胞外并发挥促炎性DAMP的作用。
外泌体资讯网 Nature communications:选择性包装线粒体蛋白到细胞外囊泡中可防止线粒体损伤分子模式(DMAPs)的游离释放