南开大学附属天津市第三中心医院高英堂课题组在J Extracell Vesicles杂志发表文章,报道了一种优化的干细胞培养方法,用于人诱导多能干细胞来源的小细胞外囊泡(sEV)的分离。2007年证明了体细胞的重编程,最终导致人类诱导多能干细胞(hiPSC)的形成。hiPSC不仅在细胞形态和表面抗原方面类似于胚胎干细胞(ESC),而且它们还具有多向分化功能和无限的增殖能力。而且, hiPSC可在体外分化成多种成熟的体细胞;例如,它们在临床中的应用将缓解胚胎干细胞的使用带来的道德和伦理问题,hiPSC在再生医学领域变得越来越受欢迎。然而,为了实现临床应用,需要克服hiPSC中肿瘤形成的问题。大多数活细胞通过旁分泌作用释放细胞外囊泡(EV),由于它们能够主动转运各种功能蛋白、mRNA、microRNA和脂质,因此它们在细胞间通讯中起着关键作用。近年来,一些研究人员发现EV与疾病进展和癌症转移有关。也已鉴定出源自hiPSC的EV在多种疾病中均具有突出的治疗潜力。因此,一些研究集中在来源于hiPSC的EV的生物学特性和提取方法上。根据用于细胞外囊泡研究的指导要求(MISEV2018),小型细胞外囊泡(sEVs)是可以用来描述这些囊泡的合适术语,尤其是当使用一种方法来选择小于200 nm的囊泡而不确定它们的细胞内起源。该研究使用sEV而不是外泌体,因为分离的EV是直径小于200 nm的囊泡,并且是通过220 nm过滤的差异超速离心方法提取的。要提取源自hiPSCs的sEV,必须准备适当的提取介质,以确保hiPSC的多能性,并能够收集细胞上清液并提取具有生物活性的sEV。以前的文献描述了从各种细胞来源收集sEV所需的条件培养基,例如血清适应性低的条件培养基或无血清培养基。但是,很少有研究专门讨论从iPSC收集sEV所需的提取介质。从hiPSC收集sEV时,重要的是提取具有生物活性的sEV并优化培养基,以最大程度地降低sEV的影响,同时保持iPSC的多能性。因此,该研究选择了敲除血清替代品(KSR),这是一种具有确定的营养成分的血清替代品。此外,在sEV的提取过程中,优化并使用了两种方法:传统的超速离心方法和试剂盒提取和纯化sEV,并确定是否在上述条件下从hiPSC收集的培养上清液可以提取具有生物活性的sEV。该研究使用了两行hiPSCs作为sEVs供体细胞,以确定收集hiPSCs培养上清液的最佳培养条件。此外,使用改进的超速离心和试剂盒提取sEV,验证了提取的sEV是否具有生物活性,从而为sEV的后续研究奠定了基础。 该研究优化了人诱导多能干细胞(hiPSCs)的培养条件、上清液收集时间和sEVs提取方法。首先,hiPSCs在含有不同浓度(0%,0.25%,0.5%,0.5%,2%,5%和20%)的细胞外泡泡去除血清替代品的细胞外膜泡生产培养基(EVs-PM)中进行培养,并连续5天收集培养上清液。然后,分离出sEV,然后对其特性进行评估。在含有0.5%至20%ED-KSR的EVs-PM中培养的hiPSCs系的存活率没有显著差异(P> 0.05)。在第1天、第3天和第5天连续收集培养上清液后,hiPSC在0.5%ED-KSR中的存活率无统计学意义(P> 0.05)。在连续收集上清液5天后,hiPSCs表达了一些多能性标志物,而SSEA4和TRA-1-60的表达逐渐变化。两种方法提取的sEV均为50-200 nm,双层且呈椭圆形或圆形的细胞囊泡,并表达标记蛋白CD63、TSG101和HSP70。在第1天、第3天和第5天提取的sEV的特征在annexin V阳性亚群的形态、大小和相对数量上几乎相同。PKH67染色表明,sEVs可以被HepG2细胞内吞并聚集在细胞质中。增殖实验表明,sEVs可以促进细胞增殖。结论是0.5%的ED-KSR是最佳浓度,并且hiPSCs培养上清液可以连续收集5天,同时保持高细胞活力和一些多能性特征。
该研究优化了人诱导多能干细胞(hiPSCs)的培养条件、上清液收集时间和sEVs提取方法。首先,hiPSCs在含有不同浓度(0%,0.25%,0.5%,0.5%,2%,5%和20%)的细胞外泡泡去除血清替代品的细胞外膜泡生产培养基(EVs-PM)中进行培养,并连续5天收集培养上清液。然后,分离出sEV,然后对其特性进行评估。在含有0.5%至20%ED-KSR的EVs-PM中培养的hiPSCs系的存活率没有显著差异(P> 0.05)。在第1天、第3天和第5天连续收集培养上清液后,hiPSC在0.5%ED-KSR中的存活率无统计学意义(P> 0.05)。在连续收集上清液5天后,hiPSCs表达了一些多能性标志物,而SSEA4和TRA-1-60的表达逐渐变化。两种方法提取的sEV均为50-200 nm,双层且呈椭圆形或圆形的细胞囊泡,并表达标记蛋白CD63、TSG101和HSP70。在第1天、第3天和第5天提取的sEV的特征在annexin V阳性亚群的形态、大小和相对数量上几乎相同。PKH67染色表明,sEVs可以被HepG2细胞内吞并聚集在细胞质中。增殖实验表明,sEVs可以促进细胞增殖。结论是0.5%的ED-KSR是最佳浓度,并且hiPSCs培养上清液可以连续收集5天,同时保持高细胞活力和一些多能性特征。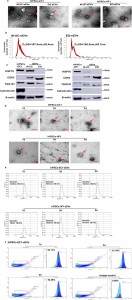 sEV的特征鉴定LuoY, Gao D, Wang P, Lou C, Li T, Niu W, Gao Y. Optimized culture methods forisolating small extracellular vesicles derived from human induced pluripotent stem cells. J Extracell Vesicles. 2021Apr;10(6):e12065. PMID: 33868601.
sEV的特征鉴定LuoY, Gao D, Wang P, Lou C, Li T, Niu W, Gao Y. Optimized culture methods forisolating small extracellular vesicles derived from human induced pluripotent stem cells. J Extracell Vesicles. 2021Apr;10(6):e12065. PMID: 33868601.外泌体资讯网 【JEV】南开大学高英堂组:人诱导多能干细胞sEV分离的培养方法优化


 sEV的特征鉴定
sEV的特征鉴定

 sEV的特征鉴定
sEV的特征鉴定