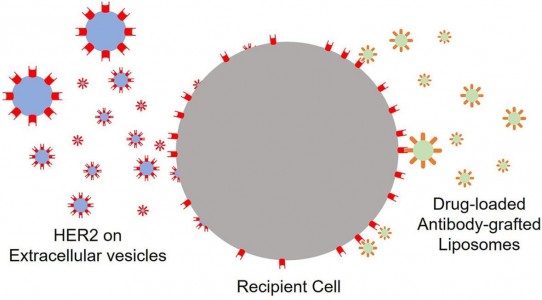
胞外囊泡(extracellular vesicles, EV)是细胞分泌的亚微米尺寸的囊泡,其携带有母细胞的相关蛋白及核酸,具有较为广泛的生物学功能。近日,来自南京医科大学附属无锡人民医院毛文君和宾汉姆顿大学万源课题组在Bioactive Materials杂志上发表文章,首次利用EV,将其携带的膜蛋白,通过膜融合的方式,传递到受体细胞膜上,再基于这些传授的蛋白进行靶向给药,达到治疗的作用,提出了肿瘤治疗的新理念。
目前基于EV的肿瘤治疗研究,主要聚焦于EV作为肿瘤疫苗及用作药物载体。通过构建特殊母细胞,使其分泌的EV携带治疗性蛋白/核酸,再将收集的EV用于肿瘤治疗也是目前研究热点。本研究则是首次利用EV的基本特性,将其携带的膜蛋白,通过膜融合的方式,传递到受体细胞膜上,完成对受体细胞的“改性”。继而这些被“安插”到受体细胞膜上的蛋白,可作为靶向治疗的靶点。该“物理性”改性策略,相较于传统的“化学性”办法要简单高效。传统策略,是利用表观遗传药物,去改变细胞的膜蛋白表达,进而产生新治疗靶点。效率相对较低,且对正常细胞有不同程度的影响。综上,该研究的意义在于,首先利用EV对受体细胞进行“调整”以利于后续的靶向给药和靶向治疗。该研究提出了肿瘤治疗的新理念,为未来肿瘤治疗提供了更多的方案。
本研究,利用肿瘤细胞系MDA-MB-231细胞作为研究对象,完成了相关测试,并在动物模型上进行了验证。MDA-MB-231细胞缺乏雌激素受体,孕酮受体,不表达或者表达很少量人类表皮生长因子受体-2 (HER2)。故靶向给药,靶向治疗(如单抗)的效果均不理想,这类代表性的低表达或不表达HER2的肿瘤患者预后较差,即使高表达HER2,患者的预后同样较差。研究人员首先收集HER2高表达的BT-474细胞分泌的EV。这些EV自然携带有大量的HER2。再将这些EV去培养MDA-MB-231细胞,EV可以有效地通过膜融合的方式,将HER2传递到MDA-MB-231细胞膜上。传递效率与EV的量及培养时间呈正相关。当有足够量HER2存在于MDA-MB-231细胞表面时,HER2抗体修饰的脂质体可以更高效递送紫杉醇到MDA-MB-231细胞,提高了治疗效果,并可有效降低药物的毒副作用。小鼠体内实验,则是将EV直接进行瘤内注射,其与肿瘤细胞发生膜融合后,再予以静脉给药。实验组肿瘤体积相较于对照组有明显缩小。
研究人员同时指出,EV不仅能“物理性”地改变膜蛋白,也可以“化学性”的改变膜蛋白构成。即利用EV包裹相关mRNA,递送给受体细胞,通过翻译,自然表达相关蛋白。但两种方式均是暂时性的。为维持治疗效果,治疗前,均需利用EV对细胞“改性”,然后再完成相关治疗。但无论如何,相较于表观遗传药物的“化学性”改性,EV治疗相对温和,系统性毒副作用也较低。后续研究可以着力于(1)提高EV-细胞膜融合效率,了解膜融合相关动力学;(2)尝试利用EV包裹mRNA,转座子去对受体细胞进行“改性”等。总而言之,该研究为肿瘤靶向给药及靶向治疗提供的新思路。
参考文献
ZacharyQuinna,WenjunMao*,Yiqiu Xia,Rhea Johna,Yuan Wan*.Conferring receptors onrecipient cells with extracellular vesicles for targeted drugdelivery.Bioactive Materials, 2021, 6(3): 749-756.https://doi.org/10.1016/j.bioactmat.2020.09.016
外泌体资讯网 【Bioactive Materials】将胞外囊泡携带的膜蛋白通过膜融合传递到受体细胞膜上以利靶向给药治疗肿瘤