胞外囊泡(EV)是细胞分泌的具有脂质双层包裹结构的囊泡,携带有母细胞的相关蛋白及核酸,具有较为广泛的生物学功能。肿瘤来源的EV在引起肿瘤转移、塑造适合肿瘤转移的条件及帮助肿瘤逃避免疫监视等方面都发挥重要作用,其EV有望成为肿瘤诊断、病情监测、疗效评估的新型生物标志物。EV也能作为肿瘤疫苗和药物载体。前者可以“训练”免疫系统,对肿瘤抗原进行识别并作出应答。后者作为天然药物载体,尤其是自体EV,可有效装载药物,逃避免疫清除,跨越体内物理屏障,将包裹的药物有效递送到受体细胞的胞浆。目前研究热点都集中在EV作为药物运载工具,但尚无研究探索利用EV改变受体细胞的表型,以供后续治疗。
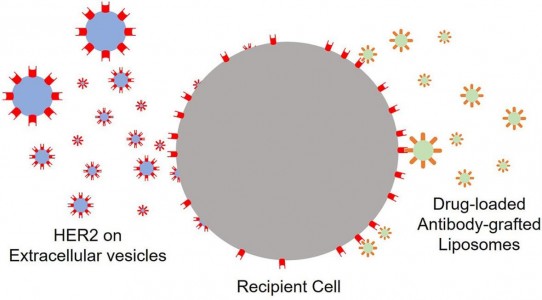
在本研究中,研究人员利用EV基本的膜融合功能,将功能膜蛋白转移到受体细胞膜上,以便开展靶向药物递送。简而言之,过表达HER2的BT-474细胞释放的EV,通过膜融合将一定量的HER2传递至HER2低表达的MDA-MB-231肿瘤细胞上,再利用抗HER2抗体修饰的脂质体更高效递送紫杉醇到MDA-MB-231细胞。本研究结果在体外体内实验中均得到验证。该研究的意义在于,利用EV对受体细胞的表型特征进行修改,增加药物治疗靶点,便于后续的靶向给药和肿瘤免疫治疗,为未来肿瘤治疗提供了新思路。
在未来的工作中,将着力于(1)提高EV-细胞膜融合的效率;(2)利用优化的EV包裹特定的mRNA/转座子等,构建新型基于EV的肿瘤疫苗。
参考文献
ZacharyQuinna,WenjunMao*,Yiqiu Xia,Rhea Johna,Yuan Wan*.Conferring receptors onrecipient cells with extracellular vesicles for targeted drugdelivery.Bioactive Materials, 2021, 6(3): 749-756.https://doi.org/10.1016/j.bioactmat.2020.09.016
外泌体资讯网 【Bioactive Materials】将胞外囊泡的膜蛋白融合至受体细胞膜以授予受体细胞新抗原供靶向药物递送