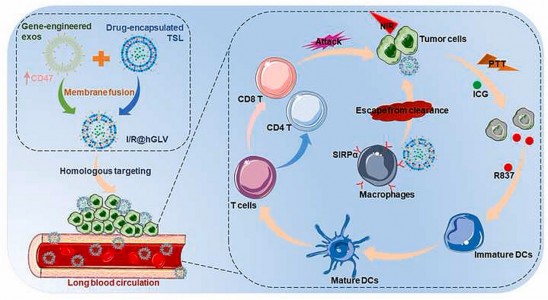
CD47在肿瘤细胞上过表达,通过与SIRPα结合激活“不要吃我”信号,导致免疫逃逸。近日,来自中山大学生物医学工程学院刘杰课题组的研究人员在Biomaterials杂志上发表论文,他们将基因工程外泌体与载药热敏脂质体融合,设计了一种混合治疗性纳米囊泡(命名为hGLV),证明了CD47过表达的hGLV 表现出长的血液循环,并通过阻断CD47信号来改善巨噬细胞介导的肿瘤细胞的吞噬作用。
基于纳米颗粒的药物递送作为一种有吸引力的策略已被广泛应用于癌症治疗。一个理想的纳米载体必须表现出独特的特性,包括在生理条件下良好的生物相容性、通过逃避单核吞噬细胞系统(MPS)在血液中保持长循环、以及最大限度地在肿瘤部位释放药物的靶向能力。然而,MPS的清除、对肿瘤部位的靶向不足以及在血液中的停留时间短仍然是有效药物递送的主要挑战。
外泌体 (exos) 是源自细胞的囊泡(直径 30-200 nm),在血液、唾液和其他细胞外体液和细胞培养基中广泛存在。外泌体具有许多突出的特性,如良好的生物相容性、几乎无免疫原性、长半衰期和无毒性。外泌体在介导细胞间通讯、调节免疫反应方面也发挥着关键作用。此外,研究表明,外泌体由于从其亲本细胞遗传而来的同源表面粘附蛋白、mRNA、DNA 和脂质分子而具有先天归巢能力。更重要的是,外泌体表面CD47(一种跨膜蛋白)的表达有利于避免MPS的免疫清除,延长血液循环时间。CD47 可以与其先天免疫细胞(如巨噬细胞)上的受体信号调节蛋白 α (SIRPα) 相互作用,激活“不要吃我”信号。比如,靶向CD47-SIRPα 信号的免疫治疗策略已被证明可以增加纳米载体靶向力并改善MPS 对肿瘤细胞的吞噬作用。人CD47阻断单克隆抗体可提高肿瘤模型中的抗肿瘤效率,并通过激活T细胞来破坏免疫原性肿瘤。外泌体表面的 CD47 表达可能会先于肿瘤细胞与 SIRPα 竞争性结合,从而增强巨噬细胞对肿瘤细胞的吞噬作用。由于这些特征,外泌体作为药物递送的潜在平台引起了相当多的关注。然而,外泌体包裹货物的不足可能会限制其药物递送应用。
混合膜纳米囊泡或仿生纳米囊泡最近引起了广泛关注。通常,混合纳米囊泡是通过将细胞膜囊泡或外泌体与脂质体结合来制备的,这赋予脂质体生物功能,并在基于细胞外囊泡的药物递送系统的广泛应用。混合的纳米囊泡将具有细胞外囊泡和脂质体的优良特性,如良好的生物相容性、高负载能力、优异的靶向能力和对 MPS 的免疫逃避。例如,干细胞膜功能化负载姜黄素的脂质体,可产生具有靶向能力和受控药物释放的混合纳米囊泡。鉴于CD47阻断可能为癌症免疫疗法提供了一个有前景的方向,研究团队通过将基因工程外泌体与载药热敏脂质体融合,设计了一种CD47过度抑制的混合纳米囊泡,将光热疗法与免疫疗法相结合,通过阻断CD47免疫检查点进行癌症治疗。
光热疗法(PTT)作为一种新的癌症疗法受到广泛关注,其不仅可以利用近红外(NIR)激光照射光热剂产生热疗来消融肿瘤细胞,也可用于有效控制药物的释放。研究证明,PTT联合免疫治疗可能比单独使用PTT或免疫治疗更有效。PTT 可以诱导免疫原性细胞死亡 (ICD),并伴有损伤相关分子模式 (DAMP),可以改善癌症免疫循环。例如,肿瘤细胞表面的钙网蛋白(CRT)和三磷酸腺苷(ATP)可以诱导免疫效应细胞——如树突状细胞(DCs)——吞噬肿瘤细胞,将要死亡的肿瘤细胞产生 HMGB1)可以刺激 DCs 成熟以进行抗原呈递。PTT后消融肿瘤产生的肿瘤相关抗原,在免疫佐剂的存在下,可以刺激免疫反应。特别是,咪喹莫特R837作为免疫佐剂,是一种 Toll 样受体7 (TLR 7) 激动剂,通过在免疫系统中广泛的直接和间接功能显示出有吸引力的抗肿瘤活性。咪喹莫特可以促进DCs成熟产生促炎因子,如TNFα和IL-6,增强先天性和适应性免疫反应,抑制肿瘤的发展。
在这项研究中,研究人员通过将基因工程外泌体与热敏脂质体 (TSL) 融合,设计了一种混合治疗性纳米囊泡,将 PTT 与免疫疗法相结合,用于癌症治疗。首先,为了通过阻断CD47实现同源靶向和体内长循环,研究人员经基因转染CT26细胞获得CD47过表达的外泌体,并与TSL融合。得到的混合纳米囊泡被命名为hGLV。然后,研究人员制备了负载 hGLV 的 ICG(一种光热剂)和 R837,命名为I/R@hGLV,表征了其体外光热效应和细胞毒性。此外,通过测量DAMPs(包括CRT、HMGB1和ATP)的表达来确定PTT诱导的ICD。研究人员还探讨了hGLV处理后巨噬细胞介导的肿瘤细胞吞噬作用、hGLV在携带CT26肿瘤的小鼠模型中的生物分布、DCs的成熟和体内抗肿瘤效率。该研究表明,阻断CD47免疫检查点的混合纳米囊泡在癌症治疗中的药物递送方面的潜力。
参考文献:Gene-engineered exosomes-thermosensitive liposomes hybrid nanovesicles by the blockade of CD47 signal for combined photothermal therapy and cancer immunotherapy. Biomaterials. 2021 Jun 12;275:120964.