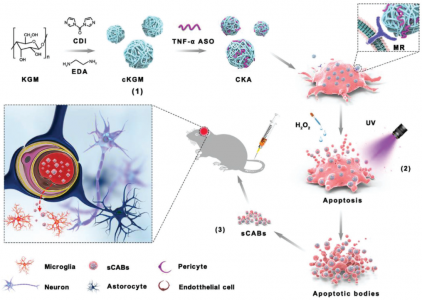
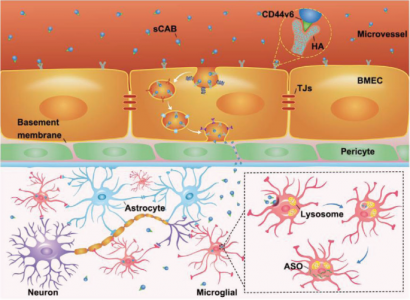
血脑屏障(BBB)是限制大多数生物分子和药物进入大脑的最严格、最复杂的屏障。急需一种有效的大脑输送策略来治疗脑部疾病。基于脑靶向细胞外囊泡 (EV) 的研究,来自南京大学董磊教授、张峻峰教授、澳门大学王春明教授合作在Advanced Science杂志(影响因子16.806)上发表文章,探索了使用来自脑转移性癌细胞的小凋亡体 (small apoptotic bodies, sABs) 进行脑靶向药物递送的潜力。以足够的效率将药物,尤其是大分子药物输送到大脑中,是治疗脑部疾病的一大挑战。在过去的几十年里,关于这个主题的许多研究都集中在血脑屏障 (BBB) 上,并且已经开发了各种方法来打破这些生理屏障的限制,但在实验室中取得了的成功有限。最近的研究表明,控制物质进入大脑的机制比我们以前想象的要复杂得多,而BBB或其他相关结构如何阻止物质从循环中流入仍不清楚。如果没有基于机制的指导,则应考虑利用穿越BBB的自然路线的策略。某些类型的癌症和免疫细胞能够有效地迁移到大脑中。虽然脑转移和脑浸润的细节尚未完全了解,但可以以某种适当的方式利用这些细胞穿透BBB的能力。例如,一些研究已经使用细胞外囊泡 (EV),例如外泌体进行脑靶向递送,最近的另一项研究表明,用表面整合靶向BBB分子设计的外泌体可有效介导脑内药物递送。然而,无法控制的载药过程和扩大外泌体生物合成的难度使得外泌体和脱落囊泡远不能满足药物要求。与活细胞产生的外泌体相比,凋亡细胞可以以更高的效率产生膜包裹的凋亡小体(AB)。更重要的是,通过标准化操作可以完全控制细胞凋亡过程。此外,由于细胞凋亡是细胞主动将其生物分子包装成囊泡的自然过程,因此它可用于将药物(如核酸)加载到AB中,效率远高于其他EV。 此外,AB膜是天然细胞的膜,因此与细胞质内组装的外泌体相比,细胞膜整合的蛋白质分子应以更大的丰度保存,这在需要特殊的膜蛋白来介导大脑传递时很重要。该研究设计了一种基于AB的递送系统,并测试了其将反义寡核苷酸 (ASO) 传递到大脑中以抑制小鼠帕金森病 (PD) 模型中脑炎症的功效。在筛选了一些脑转移细胞后,从具有高脑药物递送能力的黑色素瘤细胞系中获得了载药小ABs(sABs),并测试了它们的药物特性和治疗PD的能力。此外,将蛋白质分子CD44v6鉴定为跨BBB运输过程的介质。研究发现抗TNF-α反义寡核苷酸 (ASO) 与阳离子魔芋葡甘露聚糖 (cKGM) 结合可以通过转染/凋亡诱导过程成功加载到sABs中,并且B16F10细胞产生的sABs具有非常高的脑递送效率。进一步的研究表明,载有ASO的sABs (sCABs) 被b.End3(脑微血管内皮细胞,BMECs)转胞吞以穿透BBB,后者由CD44v6介导,并最终被大脑中的小胶质细胞吸收。在帕金森病 (PD) 小鼠模型中,sCAB通过ASO的抗炎作用显著改善PD症状。这项研究表明,来自脑转移癌细胞的sAB是脑靶向递送的极好载体,因为它们不仅具有非凡的递送效率,而且比其他EV具有更高的规模化生产潜力。WangY, Pang J, Wang Q, Yan L, Wang L, Xing Z, Wang C, Zhang J, Dong L. Delivering Antisense Oligonucleotides across the Blood-Brain Barrier by Tumor Cell-Derived Small Apoptotic Bodies. Adv Sci (Weinh). 2021 May4;8(13):2004929. PMID: 34258157.外泌体资讯网 Adv Sci:肿瘤细胞凋亡小体跨血脑屏障递送反义寡核苷酸