骨间充质干细胞来源的外泌体可促进成骨和血管生成。磁性纳米粒子与静磁场 (SMF) 相结合已被普遍用于促进伤口愈合和骨再生。来自中国医学科学院北京协和医院吴志宏、邱贵兴、王海课题组的研究人员将源自 BMSCs 的外泌体在SMF 或低剂量的 Fe3O4 纳米粒子进行预处理,发现经改造后的外泌体在骨再生中发挥了优异的促成骨和促血管生成活性。这项工作为未来组织工程的骨再生提供一种新的方案。该研究发表于Journal of Nanobiotechnology杂志上。
外伤、肿瘤或感染引起的大段骨缺损的治疗仍然是整形外科医生面临的巨大挑战,骨缺损导致的严重延迟愈合甚至不愈合损害着患者的肌肉骨骼功能。目前,骨修复的标准临床治疗方法是自体和同种异体移植,但是一些局限性来限制了广泛应用,例如供应有限、供体来源的并发症、疾病传播的风险等。骨组织工程,包括支架、细胞和生长因子,为克服这些局限性提供了前景法,近年来引起了研究人员的更多关注。
血管生成、血管生长已被认为在重塑新骨(成骨)中发挥重要作用。在没有血管网络的骨缺损中心,细胞将无法存活,新骨形成将受到阻碍。因此,必须在骨修复过程中同时改善成骨和血管生成活性,需要使用组织工程技术与支架、各种细胞和/或生物因子。
关于组织工程的细胞成分,骨间充质干细胞 (BMSCs) 是在骨缺损修复中促进成骨和血管生成的有吸引力的潜在治疗剂。BMSCs 很容易从志愿捐赠者获得,这些细胞的移植带来的抵抗发生率低,并且具有成骨特性。然而,干细胞直接移植在临床上仍存在一些挑战和局限性,如耗时长、细胞需求大、移植细胞存活率低、肿瘤形成和免疫排斥的风险。
源自干细胞的外泌体通常是内体来源的小膜颗粒,保护其内容物不受降解。外泌体向受体细胞传递各种小生物分子,包括 mRNA、miRNA 和蛋白质。最近的证据表明,干细胞主要通过旁分泌机制在组织再生中发挥重要作用,而外泌体是这些旁分泌功能的重要贡献者。外泌体表现出类似干细胞的再生特性,用外泌体直接治疗可以避免干细胞移植治疗的许多不利影响。最重要的是,外泌体不含 MHC-I 或 MHC-II 蛋白,因此克服了细胞移植治疗的缺点,很少引起明显的免疫反应。先前的研究表明,源自 BMSCs 的外泌体(BMSC-Exos)在通过递送外泌体来治疗骨再生方面表现出与 BMSCs 相似的治疗功能。
磁性纳米粒子(MNPs),如γ-Fe2O3和Fe3O4,在骨组织工程中具有巨大的潜在应用,并且可以在有或没有静磁场(SMF)的情况下促进成骨和血管生成。机械转导将作用于细胞的连续弱磁力转化为内部生化信号,是可能增强骨再生的机制。研究发现,在 SMF 刺激后插入兔胫骨的牙种植体,周围有更多新形成的骨体积,因此 SMF 促进了骨愈合。另一项研究还表明,通过显微 CT、组织学、微阵列和实时 PCR 技术证明SMF改善了牙种植体周围的骨再生。SMF 的物理机制及其生物效应可能包括电力学相互作用、磁机械相互作用和对电子自旋态的影响。研究人员之前的研究发现 SMF 通过上调 Smad4 增强了成骨分化。
此外,低剂量的 MNP 是安全的,已被美国食品和药物管理局 (FDA) 批准用于治疗缺铁性贫血,因为它们可以通过电离被吸收为铁离子并参与铁稳态。研究发现,将氧化铁纳米粒子 (IONPs) 注射到梗塞的心脏中,磁引导减少细胞凋亡和纤维化,并增强血管生成和心脏功能恢复。羟基磷灰石支架的磁信号在通过外泌体进行的成骨细胞-破骨细胞通讯中具有调节作用。源自携带 IONP 的 BMSC 的磁性纳米囊泡 (MNV) 可以有效地改善缺血性病变,因为与源自原始 BMSC 的纳米囊泡相比,MNV 包含更多的治疗分子。
应激诱导刺激和细胞活化可以调节外泌体的含量。此外,大量研究报告称,来自干细胞的外泌体可以促进成骨和血管生成。研究团队发现,来自在磁性条件下培养的 BMSCs 的外泌体增强了伤口愈合。为了进一步增强 BMSC-Exos 对骨再生的作用,在这项研究中,研究人员合成了一种新型外泌体,该外泌体来源于用 MNP(Fe3O4 纳米颗粒)或SMF刺激处理的 BMSC –Exos(BMSC-Fe3O4-Exos或 BMSC-Fe3O4-SMF)。然后在体外使用 BMSCs和人脐静脉内皮细胞 (HUVECs) 和体内临界大小的颅骨缺损大鼠模型,与 BMSC-Exos 和对照组进行比较,评估它们的成骨和血管生成活性。最后,通过对外泌体miRNA 进行测序,探索了促进骨再生的潜在分子机制。
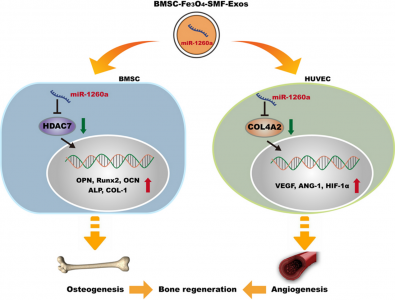
结果显示,选择 50 µg/mL Fe3O4 纳米颗粒和 100 mT SMF 作为制造两种新外泌体(BMSC-Fe3O4-Exos 和 BMSC-Fe3O4-SMF-Exos)的最佳磁性条件。与 BMSC-Exos 相比,两种新外泌体在体外和体内均被证实可增强成骨和血管生成,其中 BMSC-Fe3O4-SMF-Exos 效果最显著。这种促进作用与BMSC-Fe3O4-SMF-Exos 中高度丰富的 miR-1260a 有关。此外,miR-1260a 分别通过抑制 HDAC7 和 COL4A2 来增强成骨和血管生成。这些结果表明,低剂量的 Fe3O4 纳米颗粒与 SMF 结合触发外泌体增强成骨和血管生成,外泌体 miR-1260a 靶向 HDAC7 和 COL4A2 在该过程中起着至关重要的作用。
参考文献:Bone mesenchymal stem cellsstimulation by magnetic nanoparticles and a static magnetic field: release ofexosomal miR-1260a improves osteogenesis and angiogenesis. J Nanobiotechnology.2021 Jul 13;19(1):209.