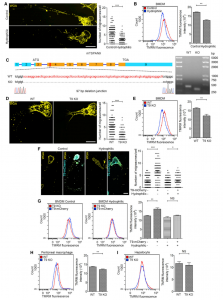
作为真核细胞的重要细胞器,线粒体受到严格的质量控制。各种机制,包括线粒体蛋白酶、蛋白酶体介导的线粒体外膜 (OMM) 蛋白降解、线粒体衍生囊泡 (MDV) 的降解和线粒体自噬已在线粒体质量控制中发挥重要作用。2021年5月27日,清华大学生命科学学院俞立教授实验室在Cell杂志发表了题为“Mitocytosis, a migrasomemedtochondrial quality control process”的研究论文。文章报道了一种新的线粒体质量控制过程——Mitocytosis,有助于介导细胞内线粒体稳态。该研究也是首次揭示迁移小体(migrasome)的自主细胞功能。

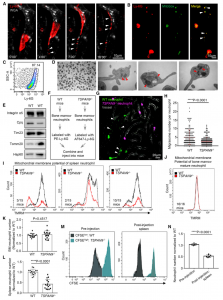
这项研究报告了mitocytosis,一种迁移小体介导的线粒体质量控制过程。研究发现,在暴露于轻度线粒体压力时,受损的线粒体被转运到迁移小体中,随后从迁移细胞中去除。机制上,mitocytosis需要将受损的线粒体定位在细胞外围,这是因为受损的线粒体避免与内部运动蛋白结合。在功能上,mitocytosis在维持线粒体质量方面起着重要作用。增强的mitocytosis保护细胞免受线粒体压力源诱导的线粒体膜电位 (MMP) 和线粒体呼吸损失;相反,在正常条件下,阻断mitocytosis会导致MMP和线粒体呼吸功能丧失。在生理上,证明mitocytosis是维持体内中性粒细胞MMP和活力所必需的。报道提出mitocytosis是迁移细胞中重要的线粒体质量控制过程,将线粒体稳态与细胞迁移相结合到了一起。| 迁移体,一种细胞亚结构,是近年来由清华大学俞立教授团队发现的一种膜性细胞器,迁移体的大小大约在0.5 μm到3 μm之间,膜泡内还包含着数量不等的直径在纳米级别的小囊泡。迁移体的产生依赖于细胞的迁移运动,可作为一种新的方式向胞外释放胞质成分。据了解,俞立教授2012年初次观察这一独特的现象时,通过使用亚细胞分离法分离得到迁移体, 再利用质谱技术很快鉴定出迁移体,上富集的多种蛋白,其中最主要的是一种四跨膜蛋白 4(Tspan4)。然后,利用绿色荧光蛋白标记的Tspan4,俞立实验室实时拍摄了迁移体的形成过程,并很快发现它与细胞迁移相关。2015年俞立团队首次将这一新发现发表在Cell Research杂志上,并正式命名为迁移体(migrasome)。俞立教授认为,虽然同样是囊泡,但迁移体与外泌体有着非常大的区别,两者蛋白质组成不同、遗传途径调控不同。tspan4a与tspan7在迁移体形成中的关键作用,这些基因敲除后迁移体不能形成;而外泌体形成的主要调控蛋白是CD63等。此外,外泌体在脱离细胞后会迅速无序地扩散开来,而脱离细胞的迁移体则像脚印一样标记出了细胞的移动路径。另外,俞立教授强调,外泌体是一种细胞外囊泡,而迁移体的本质是一种细胞器,在从细胞脱落成为细胞外囊泡之前,迁移体能够作为细胞的一部分执行很多功能。 |
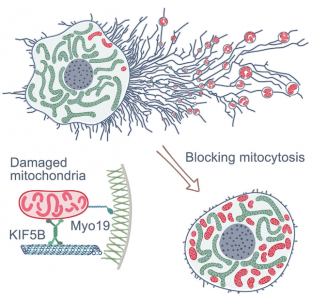
模式图:迁移细胞选择性地去除受损的线粒体,以在称为mitocytosis的过程中维持体内平衡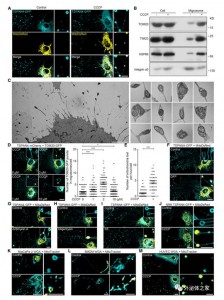
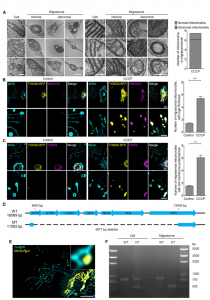
Mitocytosis在分化过程中维持巨噬细胞线粒体质量Mitocytosis维持体内中性粒细胞线粒体质量与静止细胞相比,迁移细胞需要消耗更多的能量来支持迁移,因此它们可能具有更高的呼吸速率、更高的ROS生成和更高的线粒体应力负荷。因此,迁移细胞需要额外的机制来减轻这种更高的线粒体压力负担。mitocytosis本质上与迁移相关,是迁移细胞中线粒体质量控制的首选机制,这是有道理的。从这个意义上说,mitocytosis将线粒体稳态与细胞迁移结合起来。Mitocytosis是由轻度线粒体应激诱导的。值得注意的是,10mM CCCP,这是用于诱导mitophagy的剂量,仅略微诱导mitocytosis。这可能是由于细胞在10 mM CCCP存在下几乎没有迁移的事实来解释的。作者推测,mitocytosis和自噬可能作为一个两齿轮系统来维持迁移细胞中的线粒体质量,mitocytosis处理轻度线粒体损伤,这可能在生理条件下经常发生,而线粒体自噬则处理与病理条件相关的严重线粒体损伤。Mitocytosis发生率相当低,这并不意外。mitocytosis是一种线粒体质量控制过程,用于处理细胞在生理条件下可能遇到的非常温和的线粒体应激。因此,我们不期望迁移的细胞会通过mitocytosis排出大量线粒体。受损的线粒体会释放细胞色素C,从而触发自放大caspase级联反应的激活。因此,从长远来看,即使是少量受损线粒体的积累也可能产生严重影响。通过不断去除受损的线粒体,mitocytosis可以帮助细胞避免与功能失调的线粒体积累相关的不利影响。这一观点得到了数据的支持,该数据表明迁移小体形成受损的中性粒细胞中的细胞活力和MMP降低。该研究发现KIF5B和动力蛋白等运动蛋白通过在调节mitocytosis中发挥关键作用来促进线粒体质量控制。值得注意的是,KIF5B 和动力蛋白可能通过其他机制促进线粒体质量控制,因为据报道,线粒体可以向迁移细胞的前沿提供ROS,其中ROS可以调节肌动蛋白动力学,并在此过程中被消耗。线粒体动力学受运动蛋白调节,ROS是线粒体毒性的重要来源。因此,由运动蛋白介导的线粒体运输也可能有助于运动蛋白在调节线粒体质量控制中的作用。JiaoH, Jiang D, Hu X, Du W, Ji L, Yang Y, Li X, Sho T, Wang X, Li Y, Wu YT, Wei YH,Hu X, Yu L. Mitocytosis, a migrasome-mediated mitochondrial quality-control process. Cell. 2021 May 27;184(11):2896-2910.e13. doi:10.1016/j.cell.2021.04.027. PMID: 34048705.外泌体资讯网 【Cell】清华大学俞立教授:迁移小体介导线粒体质量控制过程