几乎所有类型的细胞都会释放细胞外囊泡,大量的研究表明细胞外囊泡在各种生理及病理过程中发挥着重要的调节作用。但是,细胞外囊泡通常直径均在1微米以下,这就使得细胞外囊泡的分离纯化成为目前细胞外囊泡研究的主要限制性技术。目前常见的分离技术包括差速超速离心、尺寸排阻、免疫亲和捕获及聚合物沉淀等。因为它易于处理大量的条件培养基或体液,同时能够相对较好的兼顾回收率及纯度,差速超速离心成为目前研究中最常用的策略。
但是常规差速超速离心的分离策略在处理个别类型样品时的性能并不十分理想,这主要是由于常规超速离心无法依据密度区分沉降物的成分,致使一些与细胞外囊泡共同沉降的成分难以被去除,例如个别细胞释放的脂类或蛋白核酸复合物。此外,多次超速离心操作确实会在每一步损失一定量的细胞外囊泡,从而造成得率的降低。因此,在常规差速超速离心的基础上有研究者开发了基于30%蔗糖溶液的密度梯度超速离心策略。最初的密度梯度超速离心分为两步,首先通过超速离心获得沉淀;再重悬后使用30%蔗糖溶液进行密度梯度离心,利用蔗糖的密度(1.12 至 1.18 克/毫升)与外泌体的密度(1.15 至 1.19 克/毫升)相当,产生缓冲效应,保持外泌体的完整性并去除高密度(1.22 克/毫升)的蛋白质污染物;最后再通过超速离心收集纯化的细胞外囊泡。但是,这一方法相对操作步骤更多,得率会略有下降。
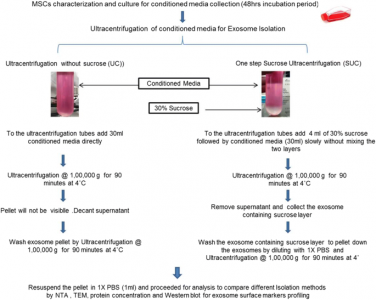
在差速超速离心方法表现差强人意的样本上,只能通过密度梯度离心来实现细胞胞外囊泡的纯化和分离吗?其实不然,针对这一问题已有学者进行了技术优化来同时兼顾效率和纯度。在这项技术优化研究中,基于蔗糖的密度和缓冲特性,研究者们开发了一种改良的一步法蔗糖垫缓冲超速离心 (SUC) 方法来分离细胞外囊泡,并将其与常规的差速超速离心进行了比较。
该研究中采用的一步法蔗糖垫超速离心策略与常规差速超速离心策略流程图
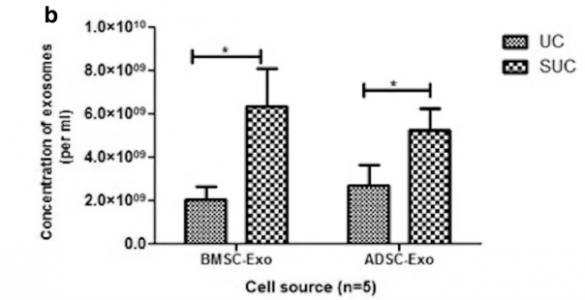
研究证实,一步法蔗糖垫缓冲超速离心方法相较于常规的差速超速离心方法能够获得更好的产量、细胞外囊泡完整性更佳和蛋白质污染物也更少。分离出的细胞外囊泡的大小、形态、产量和表面标记蛋白表达均能够被正常检测和表征。经典的蔗糖垫超速离心策略通常需要先经过超速离心对细胞外囊泡进行预浓缩,再PBS重悬后利用30%蔗糖密度超速离心进一步纯化,多次的操作极易带来得率的降低。而该研究所提倡的一步法则直接将蔗糖垫用于样品中细胞外囊泡的浓缩,即体液或细胞上清液直接添加于蔗糖垫之上,收集蔗糖垫使用PBS稀释后再次离心得到细胞外囊泡即可。去掉了预浓缩步骤,也减少了沉淀形成的次数(仅需再最后一步形成沉淀)。研究者们将修改后的方法与常规差速差速离心方法进行了比较。该方法显示出更好的细胞外囊泡形态的完整性及更高的细胞外囊泡得率。从事特殊样本细胞外囊泡研究的朋友们可以尝试该方法以优化自己的细胞外囊泡分离策略。
一步法蔗糖垫超离策略与常规差速超速离心策略得率对比
参考文献:An improvised one-step sucrose cushionultracentrifugation method for exosome isolation from culture supernatants ofmesenchymal stem cells
外泌体资讯网 如何提升超速离心分离外泌体的得率