淋巴结转移性膀胱癌 (BCa) 患者的预后极差。 BCa细胞衍生的外泌体作为重要的生物活性载体,介导肿瘤微环境中触发肿瘤转移的信号转导。然而,BCa细胞外泌体介导的淋巴结转移的机制此前尚不清楚。
近日,来自中山大学孙逸仙纪念医院林天歆、黄健、陈长昊和广州市第一人民医院谢克基课题组的研究人员通过高通量测序鉴定了lncRNA BCYRN1与淋巴结转移性膀胱癌的临床相关性。他们发现,lncRNABCYRN1 在 BCa 患者的尿液外泌体中显著上调,且外泌体BCYRN1通过hnRNPA1/WNT5A/VEGFR3 信号诱导了 BCa 淋巴结转移。该研究发表于Clinical and TranslationalMedicine杂志上。
膀胱癌(BCa)是最常见的泌尿系统恶性肿瘤之一,并且是全世界泌尿系统相关死亡的第二大原因。肿瘤转移是BCa患者预后不良的主要原因,其中淋巴结(LN)转移被认为是主要的转移方式。先前的研究表明,与淋巴结转移阴性 BCa 患者相比,淋巴结转移阳性 BCa 患者的 5 年生存率更差,从77.6% 下降到 18.6%。尽管越来越多的证据表明淋巴结转移是 BCa 的不良预后因素,但驱动 BCa淋巴结转移的确切机制仍不清楚。因此,确定引发BCa 淋巴结转移的分子机制对于探索有效的BCa患者治疗干预药物靶点具有重要的临床意义。
血管内皮生长因子C (VEGF-C) / VEGF受体3 (VEGFR3) 通路是肿瘤淋巴结转移最重要的信号之一。VEGF-C 诱导 VEGFR3 的二聚化和磷酸化,驱动主静脉细胞分化为淋巴管内皮细胞,导致肿瘤的淋巴管生成。众所周知,VEGF-C/VEGFR3 信号通路在肿瘤淋巴结转移过程中受多种生物学过程介导,包括转录调控、趋化因子诱导和信号通路之间的通讯。抑制肿瘤坏死因子α 激活的炎性巨噬细胞分泌的 VEGF-C 被认为是一种有希望的肿瘤淋巴管生成干预措施。然而,VEGF-C/VEGFR3 信号协同刺激导致 BCa 淋巴结转移的机制在很大程度上是未知的。
外泌体是直径为 30 到 150 nm 的纳米级脂质双层膜微囊泡,在跨膜结构中具有组织特异性锚定蛋白,使其能够被受体细胞高度靶向进行内吞作用。肿瘤来源的外泌体作为生物活性分子的重要载体,有助于肿瘤细胞和肿瘤微环境(TME)之间的运输。从肿瘤细胞传输外泌体以建立转移前生态位是导致癌症扩散的转移级联反应中的关键步骤。比如,外泌体将 miR-221-3p 转移到淋巴管内皮细胞以重塑 TME,诱导宫颈鳞状细胞癌的淋巴结转移。此外,靶向外泌体内容物抑制巨噬细胞极化是预防肿瘤转移的一种有吸引力的方法。然而,外泌体在 BCa 淋巴转移中的调节机制仍然未知。
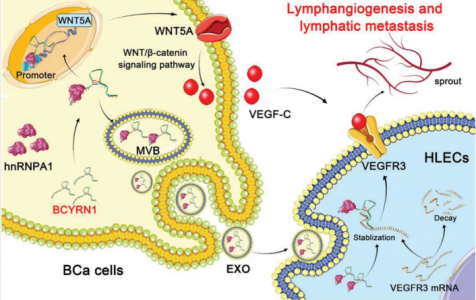
在本研究中,研究人员进行了高通量测序,鉴定了长链非编码 RNA (lncRNA) BCYRN1,它在 BCa 患者的尿液外泌体 (urinary-EXO) 中显著高表达,并且与淋巴结转移和预后不良密切相关。外泌体BCYRN1在体外显著促进了人淋巴管内皮细胞(HLECs)的微管形成和迁移,在体内促进了BCa的淋巴管生成和淋巴结转移。从机制上讲,BCYRN1 通过在 WNT5A 启动子中诱导 hnRNPA1 相关的 H3K4的三甲基化来表观遗传上调 WNT5A 的表达,从而激活 Wnt/β-catenin 信号传导以促进 BCa 中 VEGF-C 的分泌。此外,外泌体BCYRN1被传递到HLEC中并稳定VEGFR3mRNA,从而形成hnRNPA1/WNT5A/VEGFR3前馈调节通路,最终促进BCa的淋巴转移。重要的是,用特异性抑制剂 SAR131675 阻断 VEGFR3,显著削弱了外泌体 BCYRN1 诱导的 体内淋巴结转移。在临床上,外泌体 BCYRN1 与 BCa 患者的较短生存期呈正相关,并被确定为患者的不良预后因素。这项研究结果揭示了外泌体 BCYRN1 促进 BCa 淋巴结转移的确切机制,意味着靶向 BCYRN1 可能成为治疗淋巴结转移性 BCa 患者的一种新疗法。