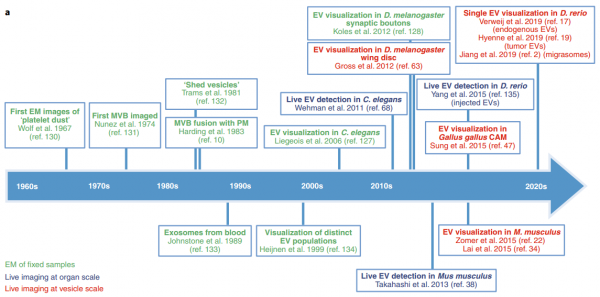
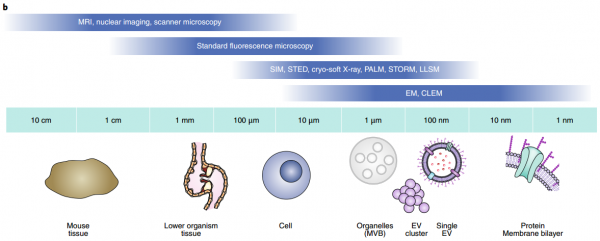
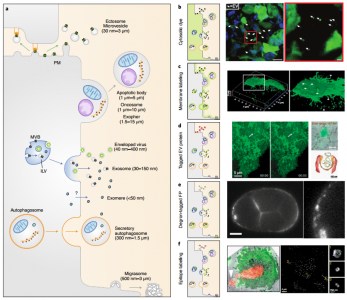
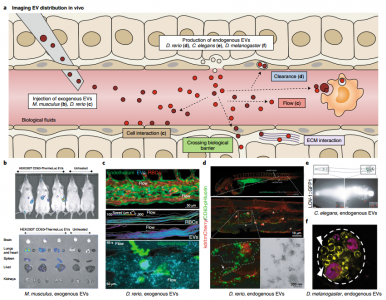
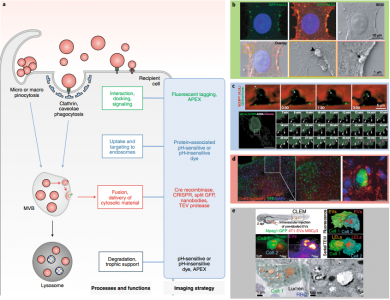
细胞外囊泡 (EVs) 是由几乎所有细胞类型释放的纳米级脂质双层囊泡。EVs具有多种生物活性,从发育、体内平衡中的作用到癌症进展,这刺激了EVs 作为疾病生物标志物和药物纳米载体的发展。然而,由于EV的体积小,大多数研究都依赖于对从生物流体中分离出来的大量EV进行分离和生化分析。尽管提供了信息,但这些方法并没有捕捉到EV释放、生物分布和对病理生理学的其他贡献的动态。实时和高分辨率显微镜技术的最新进展,结合创新的EV标记策略和报告系统,为在体内生理环境和单囊泡水平研究EV提供了新工具。近日,Nature Methods杂志发表综述批判性地回顾了EV成像的最新进展和挑战,并提出了解开EV生物学和治疗应用过程中的紧迫、突出的问题。在过去十年中,对EV生物发生途径和生物活性的了解迅速增长(图 1a、b)。EVs是膜封闭结构,迄今为止研究的所有生物体和细胞类型都将其释放到细胞外环境中。EVs是一个多样化的家族,根据亚细胞来源、大小和组成定义了亚型:内体衍生的囊泡(包括直径为50-150 nm 的多囊泡内体衍生的外泌体和分泌性自噬体衍生的EV);从质膜 (PM) 出芽的ectosomes和其他微泡,小至外泌体大小或大至几微米;分裂细胞释放的中心颗粒体残余物;尾随迁移细胞的迁移小体;从死亡和分解细胞中脱落的凋亡小体;和由具有膜可塑性的转化细胞释放的大oncosomes(图 2a)。最近的发现揭示了微粒和纳米颗粒的其他亚类,例如exophers、外泌颗粒(exomeres)、超分子攻击颗粒和细长颗粒。1980年代初期的初步发现表明EV与细胞粘附(称为“粘附子”)和清除有关,并在1990年代中期发现与免疫调节有关。EV在神经退行性疾病、癌症进展、代谢稳态、血管生成、炎症、神经元可塑性、迁移、营养支持和病原体感染中也发挥着至关重要的作用。这些作用主要由EV将分子从一个细胞穿梭到另一个细胞的能力提供支持。尽管EV生物学具有明显的重要性,但EV研究面临着由EV的小尺寸和异质性带来的挑战。大多数研究使用了从生物体液或扩展的大规模体外细胞培养物中批量分离和表征异质性EVs。这些方法允许在群体水平上进行可靠的表征,例如,大小和分子概况,但从它们的环境中去除EVs排除了对亚细胞起源、释放和吸收动态以及半衰期的了解。分离还会破坏支链聚糖等脆弱成分,从而可能改变EV的功能。 此外,二维 (2D) 单一培养的研究不一定反映体内发生的情况。实时和高分辨率显微镜的最新进展,结合新的EV标记策略,现在使我们能够在活生物体的单囊泡水平上探究EV的组成和行为(图 1a)。 EV蛋白和RNA的功能转移也可以使用新的报告基因在体内和体外进行评估。这些发展为EV生物学开辟了新的前景,提供了检查以前难以解决的问题的方法,例如评估EV在体内的寿命。该文回顾了动物模型系统中EV标记和跟踪的最新技术。识别陷阱并提出解决方案和最佳实践。最后,讨论了成像的最新进展如何解决EV生物学中的开放性问题,从生物发生到摄取和功能,从而促进EV疗法的发展。该领域的未来在很大程度上取决于在体外和体内比较每种EV标记和成像策略的优缺点的系统方法,以确定它们的相关性并确定良好的实践。我们预见成像方法和其他技术(如合成生物学工具)之间的重要协同作用的发展,以研究体内EV生物学;例如,通过控制和验证体内EV的分泌和命运,并促进体外特定EV亚群的下游分析。成像现在是研究EV的科学家工具箱的一部分,他们将与其他纳米科学家合作,进一步阐明EV的生物学和治疗应用。VerweijFJ, Balaj L, Boulanger CM, Carter DRF, Compeer EB, D'Angelo G, El Andaloussi S,Goetz JG, Gross JC, Hyenne V, Krämer-Albers EM, Lai CP, Loyer X, Marki A, MommaS, Nolte-'t Hoen ENM, Pegtel DM, Peinado H, Raposo G, Rilla K, Tahara H, ThéryC, van Royen ME, Vandenbroucke RE, Wehman AM, Witwer K, Wu Z, Wubbolts R, vanNiel G. The power of imaging to understand extracellular vesicle biology invivo. Nat Methods. 2021 Aug 26. doi:10.1038/s41592-021-01206-3. Epub ahead of print. PMID: 34446922.外泌体资讯网 【综述】Nature Methods:成像在体内了解细胞外囊泡生物学的力量