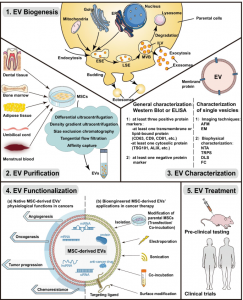
细胞外囊泡 (EV) 是细胞来源的膜结构,已成为多种生理和病理过程中必不可少的细胞间通讯调节剂。间充质干细胞 (MSCs) 可以通过MSC衍生的EVs调节肿瘤进展。近日,来自四川大学华西口腔医学院李龙江课题组的研究人员在Journal of Hematology & Oncology杂志上发表综述,讨论了关于MSC衍生的EV在癌症治疗中的作用,并总结了工程化MSC 衍生的EV作为抗肿瘤药物递送平台的应用及临床转化障碍。细胞外囊泡 (EV) 是纳米级双层膜结构,包含蛋白质、脂质、RNA、代谢物、生长因子和细胞因子,充当细胞之间的多功能转运体。EV于1967年由 Peter Wolf 首次发现,最初被认为是“血小板尘埃”。在过去的 50 年中,有关EV的信息越来越多,所有细胞都可以在正常和病理过程中分泌EVs。EV可以参与各种疾病,尤其是癌症,已被证明可以在肿瘤细胞、基质细胞、成纤维细胞、内皮细胞和免疫细胞之间转移生物分子,作为旁分泌介质促进整个肿瘤微环境的交流。因此,EVs 参与癌症的发病机制、进展、转移和免疫调节。肿瘤学状态与 EV 在生物体液中的存在之间的相关性,使得EV作为一种有效的诊断工具,用于肿瘤生物标志物识别进行微创液体活检。EV 更常见的应用是将功能性货物输送到目标细胞的运输特性,使其作为药物输送工具。一些含有内源性抗肿瘤生物分子的天然 EV 可用作治疗剂。此外,运输特定货物和靶向特异性的生物工程EV在癌症治疗中拥有更光明的前景。同时,与其他常用的药物递送载体(例如脂质体)相比,生物工程化的EV具有其内在靶向能力、低免疫原性、高修饰灵活性以及生物屏障渗透性等优点。由于EV是内源性细胞产物,需要亲代细胞来源才能获得。如今,用于治疗应用的EV通常源自间充质干细胞 (MSC),这是一种具有良好特征的细胞类型,可用于 EV 大规模生产。MSC,也称为多能间充质基质细胞,是多能成体干细胞,可从骨髓、脐带组织、胎盘组织、脂肪组织和牙组织中获得。由于MSC在体外和体内具有分化为中胚层和非中胚层组织的潜力,这些细胞具有再生能力,是治疗各种组织损伤的首选。此外,已发现MSC主动迁移至炎症部位并调节免疫反应。MSCs在癌症中的治疗作用上也有相应进展。MSCs可以优先向肿瘤迁移并被进入肿瘤基质。现在已经确定,MSCs 可以以旁分泌方式而非细胞本身去调节肿瘤细胞的命运。MSC衍生的EV是旁分泌效应的主要贡献者。此外,MSC衍生的 EV具有显著的生物工程潜力,因为它们具有很强的向肿瘤部位迁移的倾向性。在本综述中,研究人员首先回顾了EV的生物起源及其纯化和表征技术。然后总结了有关 MSC衍生的EV在癌症中的生理功能,从参与肿瘤血管生成、增殖抑制和细胞凋亡促进,到生长和转移促进、休眠和化学抗性诱导。接下来,研究人员描述了EV载药和EV疗法制造方面的最新进展,特别强调货物和表面工程技术。通过与其他纳米载体和来自其他来源的EV进行比较,还讨论了MSC衍生的EV作为理想药物递送载体的优势。然后,基于之前的理解,研究人员详细介绍了生物工程化MSC衍生的EV作为癌症治疗中的药物输送系统的应用。最后讨论了有关MSC衍生的基于EV的抗癌应用的未来挑战和方向。总之,MSC 衍生的EV可以对肿瘤发展产生多种影响,并且由于其强大的肿瘤趋向性,可以作为有前景的抗肿瘤药物递送平台。然而,MSC衍生的EV在癌症治疗中的应用仍处于起步阶段,需要进一步研究以加速其治疗临床应用。参考文献:Therapeutic roles of mesenchymal stemcell-derived extracellular vesicles in cancer. J Hematol Oncol. 2021 Sep3;14(1):136.外泌体资讯网 【综述】四川大学华西口腔医学院:间充质干细胞衍生的细胞外囊泡在肿瘤治疗中的作用