细胞外囊泡 (EV) 是细胞间通讯的载体,在生理和病理条件下从各种细胞类型中释放出来。近日,来自山西医科大学口腔医学院王兴、任秀云课题组的研究人员在Journal of Controlled Release杂志上发表综述,回顾了EV和外泌体的生物发生机制、调节EV释放的方法和治疗进展,并探讨了EV的副作用和目前挑战。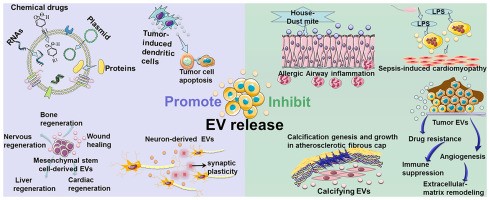
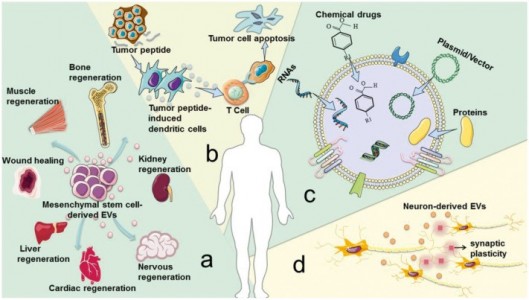
细胞外囊泡 (EVs) 在病理生理条件下从细胞中释放出来,并可以从各种体液中分离出来。根据其生物发生机制,EVs 分为三种类型:外泌体(30-100nm EVs 来源于内吞途径);微泡 (MV)(从质膜萌芽的 50-1000nm EV);凋亡小体(来自凋亡细胞的 1-5-μm EV)。目前的研究侧重于前两种类型的囊泡,并将它们统称为EV。EV 以两种方式介导复杂的细胞间信息的交换,并作为一种有价值的治疗方法(如图1所示)。有几个例子说明了EV在治疗疾病方面的作用。(1) 在很大程度上,间充质干细胞衍生的 EV具有间充质干细胞所具备的组织再生和损伤修复作用。(2) 肿瘤肽激活树突状细胞来源的EV诱导强烈的抗肿瘤免疫反应,可用作无细胞抗癌疫苗。(3) EVs 是理想的药物输送载体,易于循环、避免免疫排斥并降低某些风险,例如不受控制的细胞分裂和致癌细胞污染。(4) 大脑中的神经元通过释放EV进行交流,促进局部和远端突触可塑性。然而,目前的生产方法产生的EV产量低,而临床疾病治疗需要大量的EV。例如,为了实现生物学结果,小鼠每次治疗通常需要109-1011EVs的剂量,这可能需要数升条件培养基和几个月时间的收集。EV产量不足极大地阻碍了其临床应用,因此为了克服实施无细胞疗法的这一瓶颈,提高EV的产量和质量至关重要。 除了作为治疗方法外,EVs 也是疾病进展的加速因素(如图2所示)。(1) 肿瘤来源的 EVs 诱导免疫抑制、肿瘤血管生成、化疗耐药和基质重塑,促进肿瘤的发展和转移。(2) 气道分泌的 EVs 参与过敏原暴露下过敏性气道炎症的发病机制。(3) 心血管组织的平滑肌细胞释放钙化 EVs,这些 EVs 在动脉粥样硬化的病理条件下包含有促进钙化的货物,一旦这些 EVs 被释放到细胞外基质中,它们就有聚集形成斑块的严重风险。(4) 脓毒症期间被脂多糖刺激的巨噬细胞会释放更多含有促炎细胞因子的 EV,这种 EV 的增加与心肌功能障碍的进展有关。关于 EV 在癌症、创伤、自身免疫性疾病、传染病和心血管疾病中的作用的类似研究已经发表了很多。因此,抑制EV释放以减轻疾病的负面影响已成为一种新的治疗策略。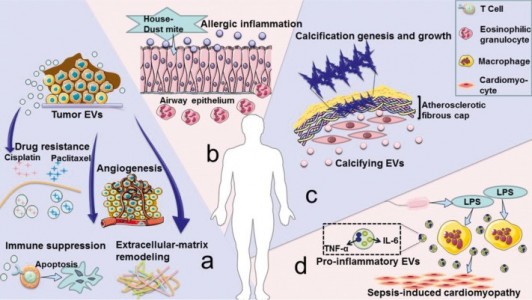
因此,在生理条件下,EV介导细胞间和组织间的通讯并参与维持体内平衡。某些EV类型已成为生物治疗剂,例如无细胞再生医学、药物递送和免疫治疗。但EV的低产量是这些疗法大规模实施的瓶颈。相反,微环境中更多的 EV促进肿瘤转移、病毒颗粒传播和神经退行性疾病的传播,抑制EV分泌可能会延迟疾病进展。因此,EV释放的促进和抑制具有巨大的研究潜力和广阔的应用前景,是一个新的、有发展前景的领域。在这篇综述里,研究人员回顾了基于 EV 生物发生机制的 EV 释放的调节方法、治疗机会,并考虑了EV应用上的副作用和挑战。参考文献:Promotion or inhibition of extracellular vesicle release: Emerging therapeutic opportunities. J Control Release. 2021 Oct 22:S0168-3659(21)00548-4.外泌体资讯网 【综述】山西医科大学:细胞外囊泡的释放控制以及疾病治疗的应用