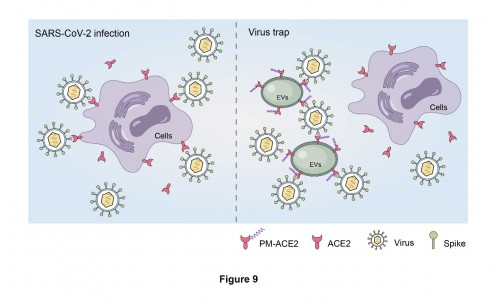
血管紧张素转化酶2(ACE2)是新冠病毒SARS-CoV-2入侵宿主细胞的主要受体,通常存在于细胞表面,通过与病毒表面的刺突蛋白(spike,S)结合,介导新冠病毒的侵染。 因此阻断宿主细胞表面ACE2和S蛋白的结合是预防和治疗新冠肺炎的主要思路。利用负载ACE2蛋白的膜泡分子作为中和病毒的“陷阱”宿主是应对新冠病毒高频突变的一个可行手段,但在具体应用到临床并进行大批量生产之前仍需解决很多问题。
近日,苏州大学生物医学研究院周芳芳教授团队与浙江大学张龙教授团队合作,在Advanced Materials(2021,19,e2103471)上发表了题为“Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy”的研究性论文。该文发现了ACE2棕榈酰化修饰的调控机制,并设计了高丰度ACE2工程型细胞外囊泡(EV)的生产策略。
该研究发现细胞表面ACE2水平以及外排的EV表面的ACE2水平均受到棕榈酰化修饰的调控。随后,该研究进一步通过串联质谱发现ACE2棕榈酰化修饰发生在Cys141和Cys498位点,并通过筛选确定ACE2的棕榈酰化酶是ZDHHC3。基于此,研究团队通过将S-棕榈酰化依赖性质膜靶向序列(PM)与ACE2融合,设计了富含棕榈酰化修饰的ACE2的细胞外囊泡(PM-ACE2-EV)。PM-ACE2-EVs的膜表面具有更高丰度的ACE2蛋白和更高的新冠病毒中和效价,能够有效保护hACE2转基因小鼠免受新冠病毒侵染。
这项研究提供了一项有效的工程型细胞外囊泡的改造策略,大大推动了工程化EV在COVID-19预防和治疗中的应用,得到了国家重点研发计划、国家自然科学基金的资助支持。
参考文献:
Engineering Extracellular Vesicles Enriched with Palmitoylated ACE2 as COVID-19 Therapy. Adv Mater., 2021 Oct 19; e2103471.