年龄相关性黄斑变性(AMD)是全球失明的主要原因。玻璃膜疣是AMD病因学的关键因素,调节玻璃膜疣生物发生的能力可能会帮助开发减缓或阻止AMD进展的治疗策略。然而,玻璃疣生物发生的潜在机制仍然大部分未知。该研究通过建立成熟的iPSC衍生的视网膜色素上皮细胞(RPE)模型,分析了其分泌的细胞外囊泡特征,从而解析AMD发病过程中玻璃疣生物发生的可能机制。
眼睛衰老的一个标志是出现玻璃膜疣,在RPE的基底层和布鲁赫膜的内胶原层之间形成的细胞外沉积物。黄斑中大量玻璃疣的存在被认为是晚期老年性黄斑变性(AMD)发展的主要风险因素,AMD是导致全球数百万人失明和视力障碍的主要原因。晚期干性AMD的特征是RPE的局灶性萎缩和黄斑光感受器的丧失;而脉络膜新生血管形成,也称为湿性AMD,涉及从脉络膜毛细血管穿过RPE层的异常血管生长。尽管玻璃疣被广泛认为是干性和湿性AMD的病因,但对其生物发生知之甚少。更好地理解这一过程可能会帮助开发治疗策略来调节玻璃疣的生物发生,进而减缓或阻止AMD的进展。新出现的证据表明,细胞外囊泡(EVs),如外泌体、微囊泡和外泌颗粒,可能参与了AMD的发病机制。EVs被定义为一把双刃剑,因为它们可以促进疾病进展或支持体内平衡维持。重要的是,虽然AMD中RPE功能障碍的传播机制仍然是我们对该疾病的理解中的一个关键空白,但已发现EV在其他神经退行性疾病中传播有毒形式的聚集蛋白方面发挥了作用。据观察,EV货物反映了其来源细胞的性质和生理学,细胞稳态的任何变化都可能改变EV的分子组成。因此,AMD期间RPE衍生的EV中包含的货物可能反映了RPE细胞的类型和生理病理状态。值得注意的是,迄今为止,尚未完成在稳态条件下对来自人类RPE组织的EV蛋白质组货物的表征,以及对类AMD环境引起的变化的分析。人类诱导多能干细胞(hiPSC)为开发基于人类细胞的疾病研究模型提供了前所未有的机会。该研究证明存在于hiPSC衍生的视网膜类器官中的RPE组织类似于天然人类RPE,并建立了一种方法来获得类似于人类原代RPE的功能成熟的极化RPE单层。此外,研究展示了RPE单层在暴露于慢性氧化应激时重现AMD关键特征的能力,包括玻璃疣样沉积物,并使用该系统分析稳态和AMD样中EV释放和蛋白质货物的动力学环境。研究证明在稳态条件下,RPE衍生的EV选择性地富含参与氧化应激、免疫反应、炎症、补体系统和玻璃疣成分的蛋白质。此外,该研究提供了第一个证据,证明玻璃疣相关蛋白通过定向分选机制从RPE细胞作为细胞外囊泡的货物释放,该机制响应AMD相关的压力源进行调节。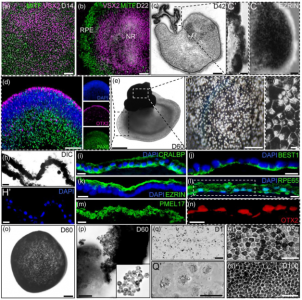
该研究证明在稳态条件下,视网膜色素上皮(RPE)细胞分泌的细胞外囊泡(EV)富含与AMD病理生理学机制相关的蛋白质,包括氧化应激、免疫反应、炎症、补体系统和玻璃疣成分。此外,证明了玻璃疣相关蛋白通过RPE细胞的细胞外囊泡以极化的顶端-基底模式释放。值得注意的是,玻璃疣相关蛋白在稳态条件下表现出独特的定向分泌模式,并且这种定向分泌的差异调节响应AMD压力源。这些观察结果支持了微调机制的存在,该机制调节定向顶端:通过EV对玻璃疣相关蛋白的基础分类和分泌,以及其响应AMD病理生理学机制的调节。总的来说,结果强烈支持RPE衍生的EV作为玻璃疣蛋白的主要来源和玻璃膜疣发育和生长的重要贡献者的积极作用。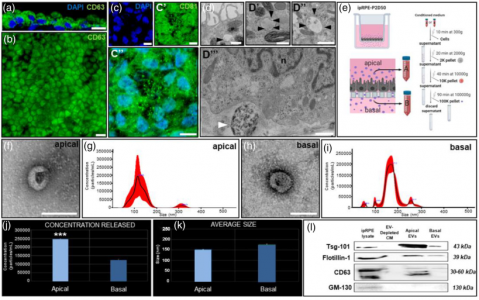
诱导初级RPE衍生的细胞外囊泡(EV)的分离和表征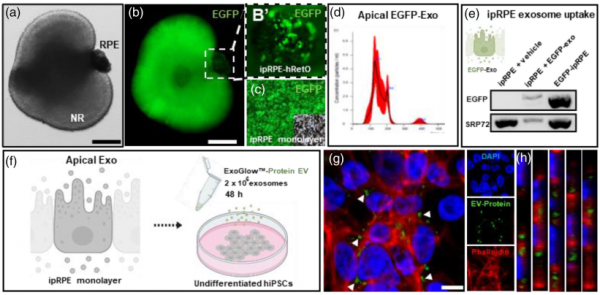
ipRPE细胞释放的EV蛋白和mRNA被靶细胞吸收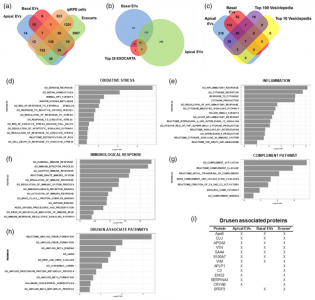
ipRPE单层及其释放的细胞外囊泡的蛋白质组学分析Flores-Bellver M, Mighty J,Aparicio-Domingo S, Li KV, Shi C, Zhou J, Cobb H, McGrath P, Michelis G,Lenhart P, Bilousova G, Heissel S, Rudy MJ, Coughlan C, Goodspeed AE, BecerraSP, Redenti S, Canto-Soler MV. Extracellular vesicles released by humanretinal pigment epithelium mediate increased polarised secretion of drusenproteins in response to AMD stressors. J Extracell Vesicles. 2021Nov;10(13):e12165. doi: 10.1002/jev2.12165. PMID: 34750957.外泌体资讯网 JEV:人视网膜色素上皮释放的EVs介导玻璃疣蛋白极化分泌增加,以响应AMD压力源