肠道是调控人类健康的基础。肠上皮细胞和免疫细胞持续暴露于数百万微生物,对肠上皮屏障和免疫功能产生重大影响。这种被称为肠道微生物群的微生物群落现在被认为是人类的重要伙伴,它们积极促进肠道以及远端器官的基本功能。
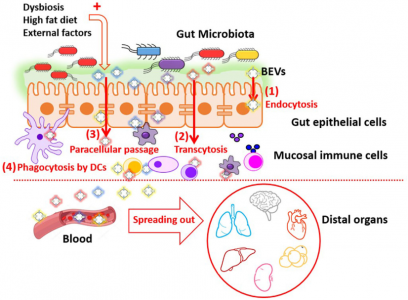
在肠道生态系统中,微生物群与宿主的双向交流不涉及细胞直接接触。微生物群和宿主来源的细胞外囊泡(EV)都是这种跨界串扰(interkingdom crosstalk)的关键参与者。现在有越来越多的证据表明细菌分泌的囊泡通过将调节宿主信号通路和细胞过程的效应分子转运和递送到宿主细胞中来介导微生物群的功能。因此,肠道微生物群释放的囊泡可能对健康和疾病有很大影响。近日JEV杂志上的一篇综述回顾了微生物群EV的当前知识,并特别强调了它们在控制宿主代谢、肠道屏障完整性和免疫训练中的作用。
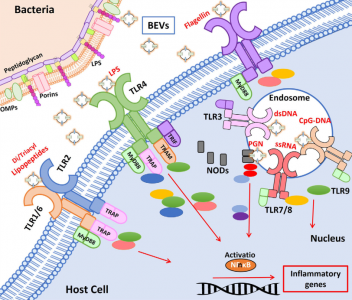
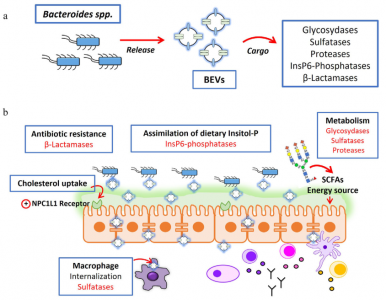
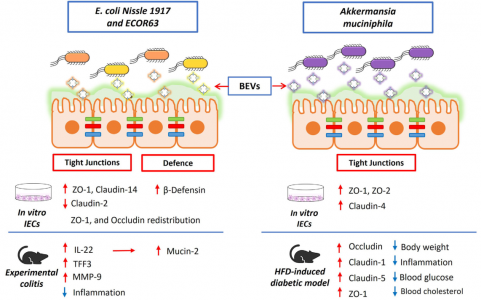
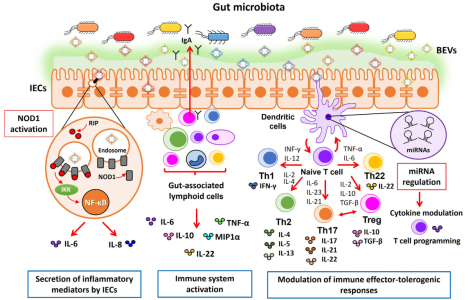
人体的皮肤和粘膜表面被大量微生物定植,统称为微生物组。定植在肠道中尤其重要,肠道微生物种群的数量超过每克结肠粪便湿重1011个生物体。肠道微生物群主要由细菌、古细菌、真菌和病毒组成。总的来说,肠道微生物群贡献了超过300万个基因,这些基因远远超过并补充了人类基因组编码的遗传信息。事实上,肠道微生物群被认为是一个“隐藏的器官”,因为微生物群编码的产物积极地促进了许多基本的宿主功能。除了在营养、代谢和能量产生方面的作用外,肠道微生物群还调节免疫稳态和针对病原体和其他损伤的炎症反应。肠道微生物群在胃肠道免疫系统发育中的关键作用已在无菌小鼠模型中得到证实。在其他改变中,无菌动物表现出免疫功能受损,淋巴器官萎缩,免疫球蛋白A(IgA)产生减少。他们更容易过敏和受到感染。肠道微生物群与肠黏膜宿主细胞建立了复杂、动态、双向的关系。由于肠道屏障的解剖结构,跨界(interkingdominteractions)相互作用不涉及直接的细胞接触。覆盖肠上皮的粘液层形成物理分离,防止管腔细菌进入下层上皮细胞。在结肠中,分泌的粘液凝胶形成的粘蛋白2形成了一个界限分明的层,分为两部分。内层非常紧凑,物理上排除了管腔细菌。此外,内部粘液层含有抗微生物肽和由针对管腔细菌的上皮细胞和免疫细胞分泌的免疫效应物。这有助于宿主-细菌空间分离。外粘液层是松散的,是大量定植肠道的细菌的粘附位点。这个外层被肠道微生物群的特定细菌降解。因此,它需要不断更新以保留内部粘液层。杯状细胞产生的粘蛋白2被Toll样受体(TLR)信号上调,以响应其被共生或机械来源的降解。与已知有助于肠道生态和食物代谢的拟杆菌衍生的BEV相关的代谢活动由于微生物群进入肠上皮细胞在物理和化学上受到限制,与宿主的交流主要取决于微生物群分泌的因子,如代谢物、蛋白质和细胞外囊泡(EVs),它们可以通过粘蛋白层到达宿主细胞肠黏膜表面。越来越多的证据表明跨界串扰主要由肠道微生物群或宿主肠道细胞释放的EV介导。该综述特别关注微生物群分泌的EV及其作为肠道细菌-宿主相互作用的关键介质的作用,讨论了它们的调节作用对肠道稳态和人类健康至关重要的功能信号贡献。示意图总结了肠道中微生物群衍生的BEV引起的免疫调节作用Díaz-GarridoN, Badia J, Baldomà L. Microbiota-derived extracellular vesicles ininterkingdom communication in the gut. J Extracell Vesicles. 2021Nov;10(13):e12161. doi: 10.1002/jev2.12161. PMID: 34738337; PMCID: PMC8568775.外泌体资讯网 【综述】JEV:肠道微生物群细胞外囊泡的功能