在一些常见的运动系统损伤,例如前叉韧带损伤、肩袖损伤等发生后,往往需要手术重建腱-骨连接部,以便恢复患者运动功能。但是腱骨愈合过程属于软-硬组织之间的组织愈合和重构,愈合困难,目前尚无有效办法进行干预。临床研究发现,在术后早期,腱骨界面会发生明显的骨溶解,影响骨长入,导致愈合延迟,是引起再次断裂,导致早期手术失败的关键原因。干预早期腱-骨界面骨溶解有利于患者术后康复,提高手术成功率。近年来以干细胞治疗为代表的生物治疗技术的快速发展,尤其是外泌体作为纳米药物载体在疾病治疗中的应用潜力为腱骨愈合的治疗提供了新思路。
近日,来自陆军军医大学第一附属医院(西南医院)运动医学中心唐康来教授课题组的研究人员以“Mir-6924-5p-rich exosomes derived from genetically modifiedScleraxis-overexpressing PDGFRα(+) BMMSCs as novel nanotherapeutics fortreating osteolysis during tendon-bone healing and improving healing strength”为题在生物材料领域国际权威期刊Biomaterials (2021, 5; 279:121242)上发表了原创性论著。王峰硕士研究生为第一作者,该工作得到了国家自然科学基金(82072516)的资助

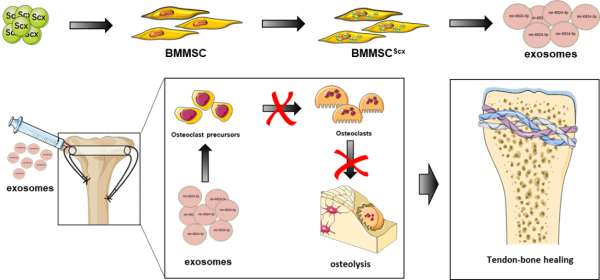 研究人员通过基因工程技术构建了Scleraxis (Scx) 过表达的骨髓间充质干细胞(BMMSC),发现其来源的外泌体可以显著抑制腱骨愈合早期破骨细胞的分化并抑制骨溶解,进而提高腱-骨愈合强度。结合外泌体miRNA高通量测序等技术,鉴定出一种尚未报道功能的microRNA,miR-6924-5p,在此外泌体中富集并发挥了关键作用。单独使用miR-6924-5p亦可显著抑制腱骨界面骨溶解并促进腱骨愈合强度。令人兴奋的是,miR-6924-5p可抑制人单核细胞的破骨分化,提示其具有临床转化价值,为腱骨愈合的快速修复提供了新的治疗思路和临床干预靶点。
研究人员通过基因工程技术构建了Scleraxis (Scx) 过表达的骨髓间充质干细胞(BMMSC),发现其来源的外泌体可以显著抑制腱骨愈合早期破骨细胞的分化并抑制骨溶解,进而提高腱-骨愈合强度。结合外泌体miRNA高通量测序等技术,鉴定出一种尚未报道功能的microRNA,miR-6924-5p,在此外泌体中富集并发挥了关键作用。单独使用miR-6924-5p亦可显著抑制腱骨界面骨溶解并促进腱骨愈合强度。令人兴奋的是,miR-6924-5p可抑制人单核细胞的破骨分化,提示其具有临床转化价值,为腱骨愈合的快速修复提供了新的治疗思路和临床干预靶点。
图:研究内容示意图
该研究率先揭示了过表达Scx的BMMSC通过外泌体途径抑制破骨细胞分化并促进腱骨愈合的分子机制,首次报道miR-6924-5p的生物学功能及其靶基因,并证实其在治疗腱骨愈合中的潜在应用价值。本研究发现为腱骨愈合的生物疗法提供了新的治疗选择和新的研究策略。
参考文献:MiR-6924-5p-rich exosomes derivedfrom genetically modified Scleraxis-overexpressing PDGFRα(+) BMMSCs as novelnanotherapeutics for treating osteolysis during tendon-bone healing andimproving healing strength. Biomaterials. 2021 Nov 5;279:121242.
外泌体资讯网 Biomaterials:基于Scleraxis过表达的工程化BMMSC来源外泌体的纳米疗法可抑制腱骨界面骨溶解并提高腱骨愈合强度




