由于胶原蛋白的过度沉积和交联,乳腺癌在进展伴随着细胞外基质(ECM)硬化,驱动乳腺癌的侵袭转移。来自印度理工学院孟买分校的研究人员发现,ECM硬度会改变外泌体的产生和血小板反应蛋白-1(THBS1)的包装,通过调节粘着斑激酶(FAK)和基质金属蛋白酶-9 (MMP-9),驱动乳腺癌细胞运动和侵袭。该研究发表于Biomaterials杂志上。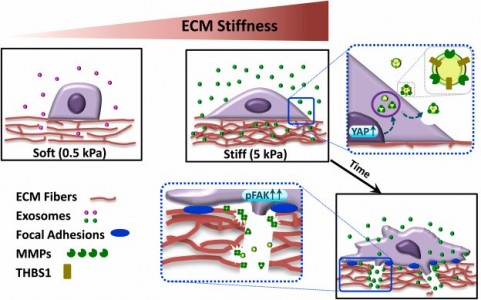
乳腺癌患者的高死亡率主要原因是乳腺癌的转移和传播。细胞外基质 (ECM) 构成肿瘤环境的物理成分,在癌症进展和转移中发挥积极作用。在乳腺癌中,肿瘤发生和转移通常伴随着由过度胶原沉积、交联和重塑引起的肿瘤内部和周围ECM硬度的增加。ECM硬度的增加会引起一系列细胞反应,最终通过整合素和PI3K信号传导和细胞收缩性增加,增强肿瘤细胞体外侵袭性和体内转移。所有这些研究都明确证明了ECM硬化对肿瘤细胞行为的直接影响,并且几乎没有证据表明ECM硬度是通过其他通信模式(如微泡或外泌体)的间接影响。最近的大量研究将外泌体确定为一种新的细胞间通讯模式,可促进肿瘤微环境不同成分之间的相互作用和重编程。外泌体是小的脂质双层纳米囊泡,通过增强肿瘤细胞迁移和侵袭、重塑细胞外基质和建立转移前生态位,促进癌症转移。外泌体介导的生物活性物质(包括蛋白质、聚糖、代谢物、DNA、RNA和miRNA)的摄取或交换介导自分泌和旁分泌信号传导。除了介导细胞间通讯外,外泌体还积极与ECM相互作用并对其进行改造。例如,基质结合的外泌体已被证明通过促进细胞-ECM 粘附组装来驱动定向细胞运动。此外,在侵袭伪足(与ECM降解相关的富含肌动蛋白的结构)部位抑制外泌体分泌会导致细胞迁移受损。虽然这些文献确定了ECM硬度和外泌体在驱动癌症侵袭中的重要性,但探索ECM硬度、外泌体分泌和肿瘤侵袭转移之间伴随联系的具体机制仍未得到探索。在这项研究中,通过结合生物物理学、蛋白质组学、基因组学和分子细胞生物学方法,研究人员证明了外泌体在ECM硬化引发乳腺癌侵袭中的作用。使用刚度可调的水凝胶ECM支架,研究人员证明ECM硬度以依赖于YAP/TAZ通路的方式促进外泌体分泌。有趣的是,通过GW4869阻断外泌体的合成和分泌可以抵消乳腺癌细胞的运动和收缩性。相反,调节ECM硬度的外泌体影响了细胞形态、粘附、突起动力学的一系列变化,从而促进了细胞运动和侵袭。外泌体裂解液的蛋白质组学分析、过表达分析和相互作用组研究揭示,与较软的ECM培养物相比,硬度更强的ECM共培养的外泌体中细胞粘附和细胞迁移蛋白更加富集。外泌体的定量蛋白质组学结合人乳腺肿瘤组织的基因组分析(TCGA数据库)确定了血小板反应蛋白-1(THBS1)作为硬度依赖性癌症侵袭的调节分子。敲除实验证实,外泌体THBS1促进了硬度调节的外泌体的侵袭性。进一步证明,外泌体THBS1通过结合基质金属蛋白酶和粘着斑激酶来介导这些作用。这项研究确定了外泌体通讯在ECM硬度依赖性细胞迁移中的关键作用,外泌体THBS1作为癌症侵袭的主要调节因子,可以进一步用作乳腺癌治疗诊断的潜在方法。参考文献:ECM stiffness-tuned exosomes drivebreast cancer motility through thrombospondin-1. Biomaterials. 2021 Oct14;279:121185.外泌体资讯网 Biomaterials:外泌体在细胞外基质硬度的调节下驱动乳腺癌侵袭