临床上器官移植开展至今,移植器官的保存、手术及术后处理已日益成熟,受者存活率已显著提高,但移植排斥反应仍然是威胁受者长期存活的重要因素。目前研究发现通过单克隆抗体阻断免疫抑制轴途径可以用来增强抗肿瘤免疫反应,然而是否可以通过增强免疫抑制轴来抑制免疫和重建免疫耐受,从而应用于抑制器官移植免疫排斥反应,这一猜想尚未得到证实。
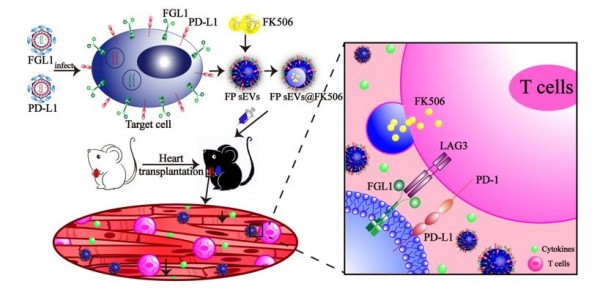
近日,中山大学药学院(深圳)的陈红波副教授和程芳副教授联合课题组与南方医科大学口腔医院的贾博副主任医师(共同通讯作者)在Advanced Science上发表了题为“Engineered smallextracellular vesicles as a FGL1/PD-L1 dual-targeting delivery system foralleviating immune rejection”的研究论文(2021 Nov 5;e2102634)。在这篇论文中,作者鉴定了LAG-3和PD-1是两个潜在的心脏移植免疫排斥治疗靶点,并成功制备了间充质干细胞来源的FGL1/PD-L1双靶点外泌体,发现其能够在小鼠异体心脏移植模型中有效减轻移植排斥,展现了良好的治疗效果与临床应用潜力。
该研究通过对肾移植病人的临床样本以及心脏移植模型小鼠T淋巴细胞上的免疫负调控分子的表达情况进行调研,发现了PD-1和LAG-3受体显著升高。而FGL1和PD-L1配体表达却没有相应的升高,无法建立免疫耐受。因此研究者决定通过构建免疫调节能力强化型的双配体分子PD-L1/FGL1外泌体,以增强其免疫调节能力。多种细胞系来源的天然外泌体无法同时高表达PD-L1/FGL1两种配体分子,并且不同细胞来源外泌体的免疫调节作用差别显著。而间充质干细胞(mesenchymal stem cells, MSC)来源的外泌体(MSC-EVs)具有MSC的大部分特性,可以通过调控T细胞和B细胞的增殖来调控适应性免疫反应,显示出优越的免疫调节能力,因此成为治疗免疫性疾病的绝佳生物载体。因此该课题组采用生物工程技术改造MSC,获得了PD-L1/FGL1双表达的MSC-sEVs。RNA-seq测序结果显示与野生型间充质干细胞相比,过表达两个配体分子虽然引起了外泌体内含物的改变,但其免疫负调控能力仍然存在。体外细胞学和体内动物实验结果均证实PD-L1/FGL1双表达的MSC-sEVs具有更强的抗器官移植免疫排斥作用。且PD-L1/FGL1双表达的MSC-sEVs联合低剂量的FK506,具有优异的重建Treg细胞和Th1/Th2的比例的能力,可起到显著的协同治疗效果。综上,基因工程化的间充质干细胞分泌的外泌体富集免疫检查点FGL1/PD-L1,能通过踩“刹车”来重建免疫耐受,有效缓解器官移植后存在的免疫排斥反应。这提示负载免疫检查点的外泌体在相关免疫疾病的治疗中大有可为。间充质干细胞来源的外泌体因其具有绝佳的优势,将成为炙手可热的生物材料,可为开发新型免疫制剂提供新的策略,也为临床上器官移植免疫排斥的治疗提供了新思路。图:高表达FGL1/PD-L1的间充质干细胞外细胞囊泡抑制心脏移植排斥反应示意图Engineered small extracellular vesiclesas a FGL1/PD-L1 dual-targeting delivery system for alleviating immunerejection. Adv Sci.2021.2102634.外泌体资讯网 Advanced Science:工程化的间充质干细胞外细胞囊泡高表达FGL1/PD-L1用于缓解免疫排斥反应