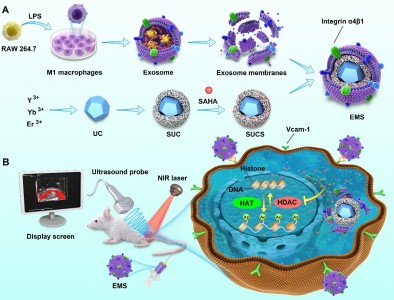
恶性肿瘤的发生一般与表观遗传调控异常有关,其中组蛋白去乙酰化酶(HDAC)的过表达会增强去乙酰化作用,从而影响抑癌基因的表达,促进肿瘤发展。组蛋白去乙酰化酶抑制剂(HDACi)可选择性地恢复抑癌基因的表达,还可间接地抑制血管生成因子的表达,阻断肿瘤部位的血液供应。但当前已制备的HDACi溶解性、循环性和组织特异性均较差,影响了其在抗肿瘤领域的应用。外泌体具有免疫原性低、循环性能优越和安全性高等特点,已被用于小分子化合物、核酸和蛋白药物的递送。但天然外泌体作为载体面临着负载效率低、性能单一等问题。近日,来自广州医科大学药学院张灵敏、余细勇课题组的研究人员基于M1巨噬细胞外泌体来源的天然磷脂膜,构建了具有时空分辨能力的人工外泌体递送平台(EMS),用于靶向递送HDACi伏立诺他(SAHA)治疗肺腺癌。该平台可高效负载SAHA,同时含有内转换材料,可用于非入侵的光声成像,实现了载药体系的时空分辨监测。该研究以“Artificial exosomes mediatedspatiotemporal‑resolved and targeted delivery ofepigenetic inhibitors”为题发表在国际杂志JNanobiotechnol上 (2021,19, 364).同时,该研究首次发现,M1巨噬细胞外泌体膜蛋白表达高水平的整合素α4β1,可与肺腺癌细胞膜上的Vcam-1受体结合,提高了SAHA的靶向递送效率。在移植瘤小鼠模型中,该EMS可在肿瘤组织中蓄积,提高了SAHA的生物利用度。这种诊疗一体化纳米药物递送平台为抗癌药物的时空分辨传递提供了一种新策略。Artificial exosomes mediated spatiotemporal-resolved andtargeted delivery of epigenetic inhibitors. J Nanobiotechnol. 2021, 19, 364.外泌体资讯网 J Nanobiotechnol:时空分辨的人工外泌体用于去乙酰化酶抑制剂的靶向递送