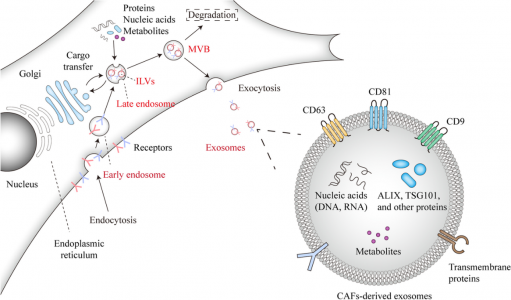
肿瘤微环境(TME)近年来受到了很多关注,特别是随着靶向免疫检查点抑制剂 (ICI) 的临床成功的出现。TME由嵌入细胞外基质(ECM)中的多种细胞类型组成,包括免疫细胞、内皮细胞和肿瘤相关成纤维细胞 (CAF)。外泌体是细胞外囊泡 (EV) 的一种亚型,在CAF与肿瘤细胞和TME其他细胞之间的通讯中发挥作用。来自荷兰莱顿大学医学中心Peter tenDijke课题组的研究人员在Molecular Cancer杂志上发表综述,介绍了CAF衍生的外泌体促进肿瘤进展的机制以及临床价值。
肿瘤是一种遗传疾病,肿瘤基因组DNA突变会导致不受控制的增殖和细胞形态变化。虽然肿瘤可以根据其位置和细胞类型分为不同的类型,但大多数肿瘤具有一系列共同特征:自给自足生长信号、无限复制潜能、转移和侵袭增加、抗生长信号的耐受、细胞死亡耐受、激活血管生成、代谢重编程和逃避免疫监视。重要的是,在功能上使抑癌基因失活或激活原癌基因产物的突变是驱动肿瘤发生的关键因素。 由于细胞活动的整合以及炎症和细胞因子的作用,肿瘤可以被定义为一种永远无法愈合的伤口。在肿瘤发展和伤口愈合时,一些信号通路被激活,具有相似性。肿瘤和伤口愈合之间的重要区别在于肿瘤细胞及其微环境中信号通路的可持续性和恶化。肿瘤发展是一个非常动态和多步骤的过程,肿瘤内的细胞是异质的,其组成在疾病进展过程中会发生变化。不仅肿瘤内的肿瘤细胞之间存在交流,而且肿瘤微环境 (TME) 中的多种细胞类型之间也存在交流。TME由多种细胞类型组成,包括基质细胞(例如成纤维细胞、间充质基质细胞、周细胞和脂肪细胞)和免疫细胞,例如T和B淋巴细胞、自然杀伤 (NK) 细胞和肿瘤相关巨噬细胞 (TAM)。所有这些细胞都嵌入在细胞外基质 (ECM)。虽然之前研究集中在干扰肿瘤细胞实现肿瘤治疗,但最近更多的研究面向TME以寻找新的肿瘤疗法。特别是,针对免疫检查点抑制剂 (ICIs) 的免疫疗法已显示出显著的长期有益效果,即使对转移性肿瘤的患者也是如此。然而,免疫疗法仅对约15%的肿瘤患者有效。最近,已经开发出ICI与抗血管生成疗法的组合来克服 ICI 单一疗法的局限性,主要是通过抑制血管生成和增加细胞毒性 T细胞向TME的浸润。这种针对TME的组合策略已在许多临床试验中证明了更多的临床益处和有希望的结果。在TME的多种基质细胞类型中,癌症相关成纤维细胞 (CAF) 是多种癌症类型TME的主要成分,包括乳腺癌、结肠癌、胰腺癌和前列腺癌。在胰腺癌中,60-70%的肿瘤块由以CAF和过量胶原蛋白和其他ECM成分沉积为特征的基质组织组成。CAF是一种高度异质性的细胞类型,其中一些亚型具有抑制癌症的作用,而其他亚型具有促癌特性。此外,CAFs可根据其特定生物分子标志物的差异表达分为几个亚型,不同的亚型发挥不同的功能。成纤维细胞在正常组织中通常是静止的,但它们可以在组织损伤期间被激活。这些位于肿瘤细胞附近的活化成纤维细胞是CAF群体的一个重要亚型。CAFs通过影响肿瘤细胞侵袭和转移、促进免疫逃避、刺激血管生成和促进化疗耐药性等多个方面调节癌症的发展。除了 ECM重塑外,CAF 还可以通过旁分泌因子(例如细胞因子和外泌体)对肿瘤发生产生巨大影响。细胞间通讯通过多种方式发生,例如通过细胞间直接接触和分泌分子或囊泡的转移。外泌体的分泌是 CAF 影响肿瘤细胞行为的重要方式。外泌体是细胞外囊泡 (EVs) 的一种亚型,起源于细胞分泌的内体囊泡。大多数外泌体是小EV(sEV),直径在30nm到150 nm 之间。这些sEV含有蛋白质、核酸和脂质,可以从一个细胞转移到另一个细胞,从而激活信号通路。TME中肿瘤细胞、免疫细胞和其他细胞类型分泌的外泌体也对肿瘤发生产生很大影响。在这篇综述中,作者专注于CAF衍生的外泌体在癌症进展中的作用。作者首先介绍CAFs 在癌症发展中的作用以及CAFs如何与TME中的其他细胞通信。然后描述了CAF衍生的外泌体如何调节肿瘤细胞和TME的其他细胞。最后,由于外泌体在肿瘤生长相关的异质生物学过程并具有治疗潜力,作者还讨论了外泌体的临床应用,特别是在免疫检查点治疗的增效作用。参考文献:Cancer associated-fibroblast-derivedexosomes in cancer progression. Mol Cancer. 2021 Dec 1;20(1):154.外泌体资讯网 【综述】Mol Cancer:肿瘤相关成纤维细胞分泌的外泌体在肿瘤进展中的作用