尽管肿瘤细胞衍生的外泌体在肿瘤转移中的重要性日益凸显,但外泌体群体的异质性在很大程度上阻碍了对其分子组成、生物发生和功能的系统表征。在本研究中,来自日本北海道大学的研究人员开发了肿瘤细胞N-聚糖的外泌体模型“荧光肿瘤聚糖纳米体”(fluorescent cancerglyconanosomes),提出了一种预测和靶向肿瘤转移前位点的新方法。该研究发表于Biomaterials杂志上。
细胞分泌的细胞外囊泡(EV)充当细胞间载体,将DNA/RNA、代谢物、脂质和糖蛋白等货物转移到受体细胞。肿瘤细胞通过分泌各种 EV,可以与邻近细胞以及在远处器官组织中的细胞进行交流。值得注意的是,来自肿瘤细胞的EVs似乎不仅改变了肿瘤微环境中周围细胞的细胞生理学,而且还改变了远处非肿瘤细胞的血管通透性和转移前微环境。
在原发肿瘤部位,癌细胞分泌的EV可以通过整合素 (ITG) 和细胞外基质纤连蛋白 (ECM) 之间的相互作用增强定向细胞粘附和运动。EVs还可以促进邻近肿瘤相关基质细胞的分化或募集。含有基质金属蛋白酶的EV的分泌直接促进ECM降解和重塑,促进肿瘤细胞的运动。这些结果表明,自肿瘤细胞衍生的EV附着在周围细胞和ECM上,重塑了肿瘤微环境特性。
更重要的是,肿瘤来源EVs在体内循环并且可以在所有体液中检测到,包括血液、唾液和尿液,这表明从肿瘤细的EVs可以介导远处部位多种细胞类型的重编程。使用Cre-LoxP系统的体内成像实验提供的证据表明,恶性人类乳腺肿瘤细胞MDA-MB-231释放的EV被位于同一肿瘤内和远处肿瘤内的恶性程度较低的肿瘤细胞吸收。小鼠胰腺导管腺癌 (PDAC) 的肝转移模型中,表达高水平巨噬细胞迁移抑制因子的PDAC EV转移到肝库普弗细胞,可以为肝转移做好准备。蛋白质组学分析表明,EVs的不同ITG 表达影响器官趋向性,其中EVs上的ITGα6β4 和 ITGα6β1 优先与肺驻留成纤维细胞和上皮细胞的层粘连蛋白相互作用,而表达 ITGαvβ5 的EVs通过纤连蛋白与肝脏库普弗细胞结合。然而几乎所有细胞上都表达ITG,EV上的ITG如何确定目标受体细胞的机制仍然不确定。
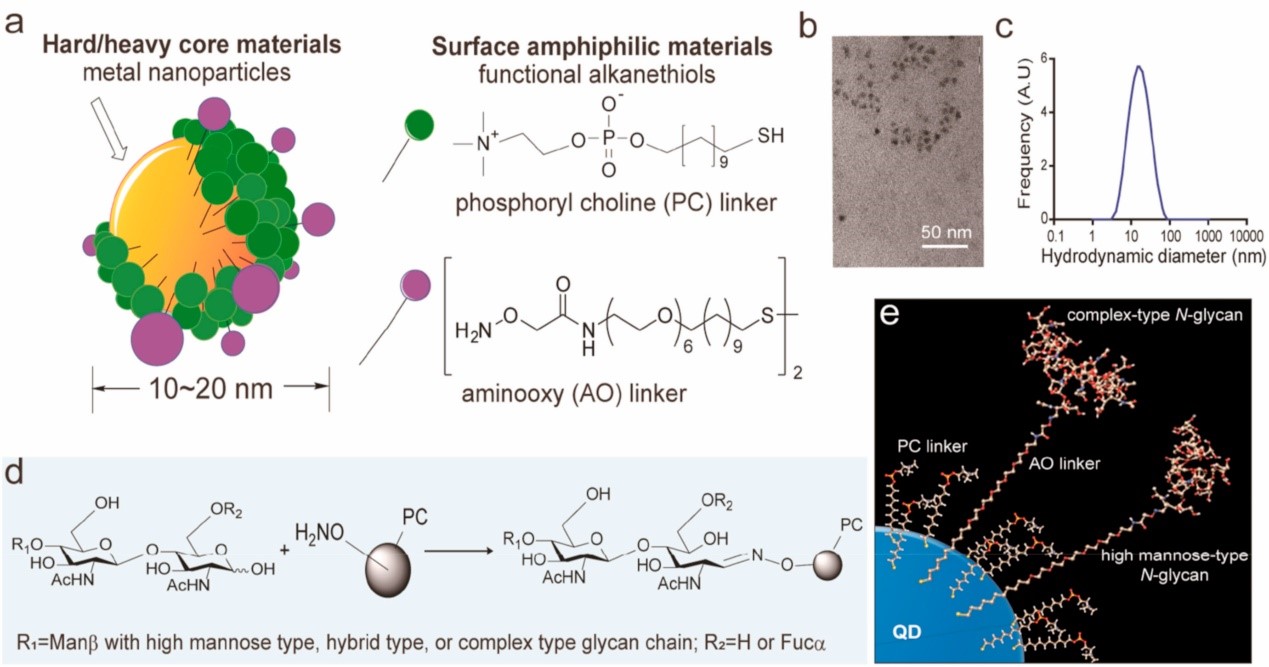
EV糖萼(glycocalyx)是一种巨大的N-聚糖结构,共价连接到膜蛋白。覆盖在EVs表面的糖萼可能在肿瘤细胞分泌的EVs的器官生物分布中作为分子决定因素具有关键作用。蛋白质 N-糖基化的改变会显著影响肿瘤生物学,包括其微环境形成和免疫反应控制。因此,肿瘤来源EV的N-聚糖的非还原末端区域可以作为肿瘤相关的表位结构,这些表位结构可以被内源性凝集素如半乳糖凝集素、siglecs、选择素有效识别。EV的N-糖基化模式与亲本细胞类型相似,而与多种分选机制相关的蛋白质N-糖基化模式可能控制将货物糖蛋白募集到不同的 EV 亚群中。,因此,作者认为EV 糖萼的N-糖基化模式与组织驻留细胞的凝集素之间相互作用的特异性和强度,可能决定了从远处原发肿瘤部位分泌的EV的循环、清除和器官生物分布。 尽管EV糖蛋白的N-糖基化模式在肿瘤转移中的重要性日益凸显,但EV种群的异质性在很大程度上阻碍了对聚糖结构及其在肿瘤转移中的功能作用的系统分析。
肿瘤细胞类型特异性N-糖基化模式的工程纳米粒子可能是研究原发肿瘤EV糖萼在向器官转移中的作用的理想工具,不会因EV的其他组成而产生偏差。许多由纳米材料制成的已知纳米药物,例如量子点 (QD)、金纳米粒子、碳纳米管和聚合物胶束,会被单核吞噬细胞系统 (MPS)的细胞迅速清除。多功能纳米体(NS) 技术具有独特的抗粘附特性,可防止非特异性蛋白质电晕的形成,已被应用于开发新型纳米颗粒。使用这种抗粘附纳米体平台,研究者们建立了一种简便有效的方法来制备人工纳米颗粒作为外泌体模型,显示肿瘤细胞类型特异性 N-糖基化模式,可以预测每种肿瘤细胞类型分泌的循环EV的体内目的地、有机生物分布和命运。
研究者们发现,小鼠中肿瘤聚糖纳米体的循环、清除和器官靶向性生物分布在很大程度上取决于肿瘤细胞类型特异性N-糖基化模式、关键糖型的组成,尤其是高甘露糖型N-聚糖的主要丰度和位置特异性的唾液酸化。值得注意的是,通过模拟肿瘤细胞类型特异性N-糖基化模式,可以人工重现肿瘤聚糖纳米体的器官生物分布,这表明纳米聚糖印迹方法可作为预测和靶向转移前位点的有希望的工具,这是由从原发肿瘤部位播散的细胞外囊泡的糖萼决定的。