门针对患病组织的治疗剂递送可增强其功效并减少其副作用。近日,来自加州大学圣迭戈分校的研究人员在Nature Biomedical Engineering杂志上发表文章,报道了对间充质基质细胞进行遗传修饰以展示趋化受体和内皮细胞结合分子后,通过密度梯度离心去除其细胞核后成为靶向递送治疗剂的有效载体。去核细胞既不会增殖也不会永久移植到宿主中,但仍保留用于产生能量和蛋白质的细胞器,对发炎的内皮细胞进行整合素调节的粘附,并积极归巢至患病组织。在急性炎症和胰腺炎的小鼠模型中,全身施用表达两种趋化因子受体和内皮粘附分子的去核细胞增强了抗炎细胞因子向患病组织的递送(相对于未修饰的基质细胞和骨髓MSC外泌体),减轻炎症和改善疾病病理。去核细胞保留了大部分细胞的功能,但获得了无细胞递送系统的载货特性,因此代表了一种多功能的递送载体和治疗系统。
由于药物在脱靶位点积累、缺乏药物选择性以及无法完全进入患病组织,因此全身给药常规疗法通常伴随着不需要的副作用和毒性。例如,IL-10和IL-12等细胞因子具有强大的免疫调节功能和治疗各种疾病的潜力,包括急性胰腺炎、炎症性肠病和癌症。然而,它们在循环中的半衰期短、在靶组织中的生物利用度低以及与全身给药相关的不良反应阻碍了临床成功。多年来,已经开发了几种靶向递送系统来解决这些局限性并提高疗效,包括基于纳米技术的药物递送系统、抗体-药物偶联物和仿生递送方法。仿生递送载体特别有吸引力,因为它们可以在化学成分、膜流动性或3D蛋白质呈现方面密切模仿生物表面的先天化学和生物特征,并且在某些情况下,具有先天的疾病靶向能力。与合成衍生的基于纳米技术的药物递送系统相比,天然衍生的药物递送载体已被证明具有更好的生物分布、生物降解、免疫相容性和降低的毒性。目前正在研究几种生物启发系统用于药物递送。它们利用细菌、病毒、红细胞、免疫细胞、干细胞、外泌体、膜囊泡或分离的膜“幽灵”。在这些系统中,间充质基质细胞(MSC)作为治疗性载体获得了大量的关注,这主要是因为它们具有内在的疾病靶向和旁分泌能力。基于化学引诱物、趋化因子、选择素、整合素或其他细胞表面粘附分子的独特表达谱,真核细胞已经进化出优异的通讯系统,以引导干细胞和免疫细胞迁移到受伤或患病的组织。细胞响应化学信号离开循环并回到患病或受伤组织的生理过程被称为趋化归巢。细胞归巢的初始阶段是由内皮细胞(ECs)表达的特定选择素以高度精确的调节方式介导的,其诱导瞬时细胞束缚和在疾病部位的内皮上滚动。这种初始粘附步骤还促进细胞暴露于内皮细胞表面显示的特定趋化因子,这些趋化因子与其同源趋化因子受体结合以激活细胞内信号反应的级联反应并导致高亲和力整合素激活。高亲和力整合素受体促进内皮细胞的牢固细胞停滞和循环中的细胞隔离。在牢固粘附时,隔离的细胞进行跨内皮迁移,穿透基底膜,然后移动到血管周围空间。响应化学引诱梯度,细胞继续通过血管外组织移动到疾病或损伤部位。细胞到达病灶后,它们会继续使用趋化机制将自身定位在受伤细胞和免疫细胞附近,以便它们可以通过膜连接和正常免疫细胞通信和愈合所需的分泌因子进行通信。许多研究表明,趋化迁移使用复杂的梯度传感机制、信号转导级联、大量能量用于肌动蛋白介导的细胞形状变化和肌动蛋白/肌球蛋白介导的力产生,以主动驱动细胞通过复杂组织到达疾病部位。细胞“破译”化学指导线索、产生能量并产生推进力以通过脉管系统外渗的特殊能力使它们与其他缺乏这些机制的纳米颗粒和生物启发药物输送系统区分开来。例如,在过去十年中开发了无细胞递送载体(CFDV)。这些包括细胞外囊泡(EV)、基于红细胞的载体和细胞膜衍生(或涂层)载体(纳米颗粒或纳米“幽灵”)。然而,CFDV没有产生能量、激活高亲和力整合素介导的内皮粘附、破译化学梯度和产生推进力所需的关键细胞器和关键细胞机制。因此,现有的CFDV既不能通过血管屏障主动趋化,也不能响应化学信号将自身推进到复杂的组织深处。理想情况下,基于细胞的递送载体可以设计为具有增强的趋化能力,以改善靶向药物递送,但这种递送系统在转化为临床之前面临一些限制。例如,尽管MSC等细胞具有自然疾病的营养特性,但系统输注后MSC对靶组织的不一致和不充分归巢被认为是导致基于MSC的疗法疗效不足的主要原因。值得注意的是,MSCs在很大程度上受限于它们在静脉内(i.v.)注射后最初滞留在肺毛细血管中、趋化因子归巢受体的表达不一致以及缺乏内皮粘附分子的表达。由于无法控制体内细胞命运,例如分泌不需要的治疗因子,不可预测的植入体内以及它们在体内分化为不需要的细胞类型,这进一步加剧了这种情况,所有这些都显著限制了可预测和可重复的治疗递送。尽管细胞工程和基因工程方法可以克服其中的许多障碍,但对具有多种基因组修饰的细胞获得监管批准仍然很困难。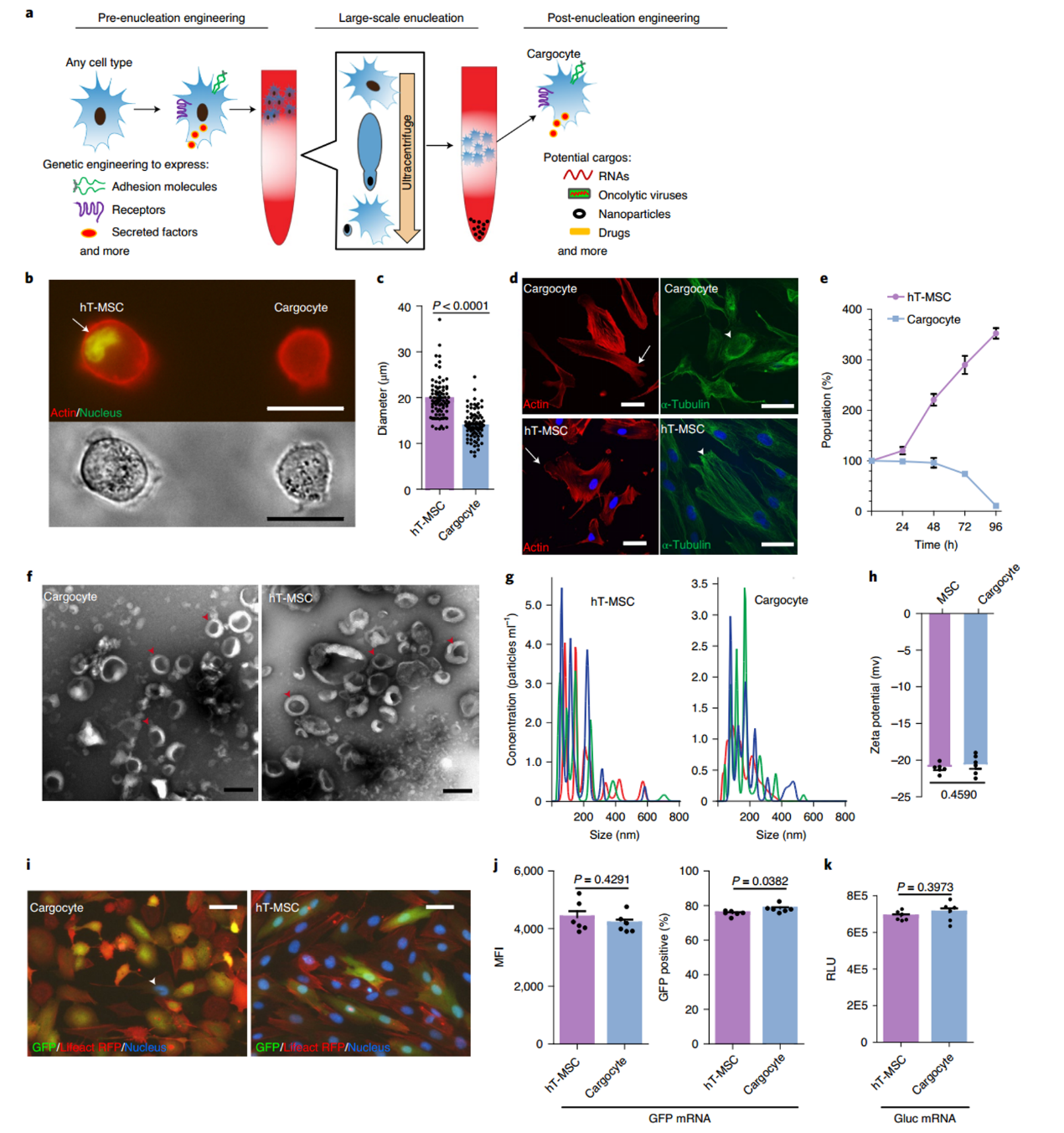
该研究报告了使用最近的生物工程技术赋予MSC多种趋化受体和内皮细胞粘附分子,这些分子介导了炎症和患病组织的归巢。为了使生物工程MSC安全可控,使用大规模物理去核来产生一种新型的疾病归巢CFDV,将其命名为“cargocytes”。Cargocytes保留了重要的内在细胞功能,例如蛋白质翻译和分泌、向确定的趋化因子信号的主动趋化迁移以及体外调节的高亲和力整合素激活和内皮细胞粘附。在两种疾病动物模型中,证明了生物工程化的细胞能够有力地归巢并将治疗性细胞因子货物输送到患病组织,从而改善疾病病理。生物工程化的Cargocytes使用主动趋化性和内皮粘附来有效且特异性地将治疗性货物输送到目标组织。WangH, Alarcón CN, Liu B, Watson F, Searles S, Lee CK, Keys J, Pi W, Allen D,Lammerding J, Bui JD, Klemke RL. Genetically engineered and enucleated humanmesenchymal stromal cells for the targeted delivery of therapeutics to diseasedtissue. Nat Biomed Eng. 2021 Dec 20. doi: 10.1038/s41551-021-00815-9.PMID: 34931077.外泌体资讯网 Nature子刊:基因工程和去核MSC用于将治疗药物靶向递送至患病组织