间充质干/基质细胞(MSC)-小细胞外囊泡(MEx)治疗已在新生儿肺损伤的实验模型中显示出前景。MEx提供有益效果的分子机制仍未完全了解。近日,Am J Respir Crit Care Med杂志(IF=25.841)发表文章报道了使用支气管肺发育不良的小鼠模型在单细胞水平上分析MEx与靶细胞的相互作用,并证明MEx与肺髓细胞相互作用,将它们恢复到正常水平,并将它们重定向到非炎症细胞表型。此外,过继转移受过MEx培养的骨髓细胞可以防止高氧肺损伤并使肺发育正常化。这些发现为MEx-骨髓细胞相互作用提供了新的机制见解,可用于进一步开发基于MEx的肺部疾病疗法。支气管肺发育不良(BPD)是一种多因素慢性肺部疾病,几乎只发生在需要机械通气和/或补充氧气的早产儿中。它的特点是肺泡形成减少,基质重塑紊乱,肺血管系统不成熟,肺功能受损,并且在一部分中度至重度BPD患者中,继发性肺动脉高压(PH)。BPD的前因,无论是氧毒性、活性氧、机械通气、感染,还是胎儿和产后炎症,都会通过常见的炎症途径造成破坏性影响。基于间充质干/基质细胞(MSC)的疗法已在众多新生儿心肺疾病模型中显示出前景。众所周知,MSCs的主要治疗方式在于它们的分泌组,最近的研究表明,其中的主要治疗载体是“小”细胞外囊泡(sEVs),这是一种包括外泌体的EV子集。值得注意的是,研究已经证明,在包括PH在内的实验性肺损伤模型中,使用纯化的人类MSC衍生的sEV(MEx)治疗可以改善甚至逆转核心组织学和功能结果,肺纤维化和BPD。事实上,在许多发生肺功能障碍和炎症的临床前模型中,基于MEx的干预措施通过调节免疫反应促进了组织修复和再生。MEx现在被认为是有效的免疫调节剂,能够调节巨噬细胞(Mf)支点并“指导”单核细胞/Mf介导的免疫反应。因此,骨髓细胞是MEx生物活性的细胞介质。尽管基于MEx的疗法向临床应用的转变令人鼓舞,但尚未完全了解MEx提供有益效果的分子机制。任何生物药物有效临床转化的关键问题包括体内生物分布的表征以及细胞靶标和下游信号的识别。该研究使用高氧诱导的新生儿肺损伤模型,试图通过详细评估生物分布和对免疫细胞表型异质性的影响来研究MEx作用的治疗机制。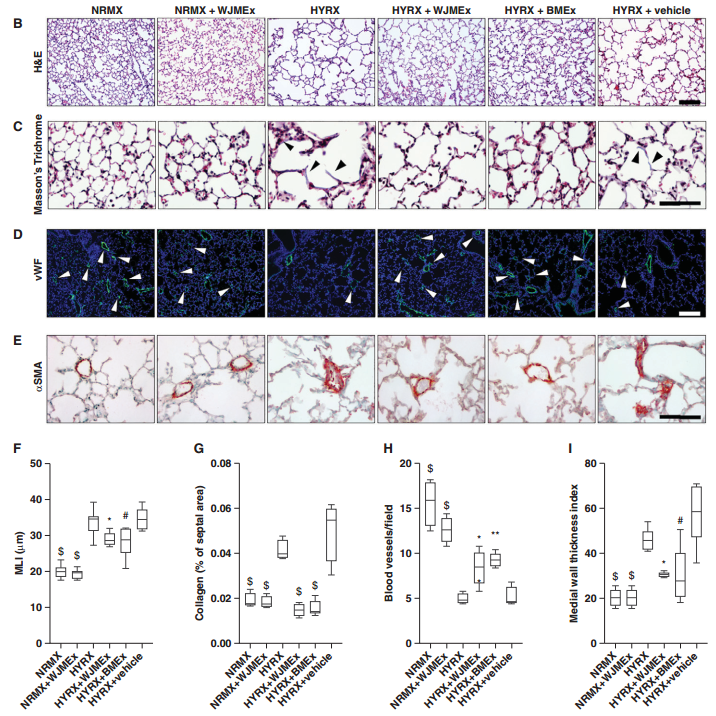
间充质基质/干细胞(MSC)-小细胞外囊泡(MEx)治疗可改善高氧(HYRX)诱导的新生儿肺损伤的核心特征目的:通过评估MEx生物分布和对免疫细胞表型异质性的影响来研究治疗作用机制。方法:从人脐带沃顿氏果冻来源的MSCs的条件培养基中分离MEx。新生小鼠从出生开始就暴露于高氧环境(HYRX,75%O2),并在出生后第14天(PN14)返回室内空气。小鼠接受PN4静脉推注MEx剂量或用MEx预处理的骨髓来源的骨髓细胞(BMDMy)。在PN4、PN7、PN14或PN28处处死动物以表征MEx生物分布或评估肺参数。在体外和体内确定了MEx教育的BMDMy的治疗作用。主要结果:MEx治疗改善了HYRX诱导的新生儿肺损伤的核心组织学特征。生物分布和质谱流式细胞技术研究表明,MEx定位于肺中并与骨髓细胞相互作用。MEx恢复了HYRX损伤肺中肺泡巨噬细胞的分配,并同时抑制了炎性细胞因子的产生。体外和离体研究表明,MEx促进了免疫抑制性BMDMy表型。功能分析表明BMDMy的免疫抑制作用是由表型和表观遗传重编程的单核细胞驱动的。过继转移受过MEx教育的BMDMy,但不是单纯的BMDMy,恢复了肺泡结构、抑制纤维化和重塑肺血管,并提高了运动能力。结论:MEx通过骨髓细胞的表观遗传和表型重编程改善了高氧诱导的新生儿肺损伤。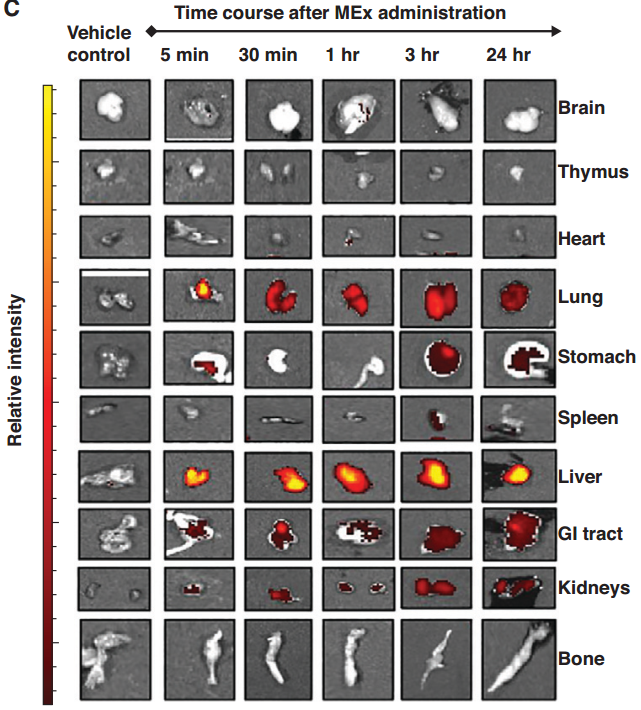
间充质干/基质细胞-小细胞外囊泡(MEx)生物分布:MEx定位于肺并与骨髓细胞相互作用WillisGR, Reis M, Gheinani AH, Fernandez-Gonzalez A, Taglauer ES, Yeung V, Liu X,Ericsson M, Haas E, Mitsialis SA, Kourembanas S. Extracellular Vesicles Protectthe Neonatal Lung from Hyperoxic Injury through the Epigenetic andTranscriptomic Reprogramming of Myeloid Cells. Am J Respir Crit CareMed. 2021 Dec 15;204(12):1418-1432. doi:10.1164/rccm.202102-0329OC. PMID: 34699335.外泌体资讯网 Am J Respir Crit Care Med:细胞外囊泡通过骨髓细胞的表观遗传和转录组重编程保护新生儿肺免受高氧损伤

