脱髓鞘疾病是一类关键的中枢神经系统(Central Nervous System,CNS)疾病,目前仍缺乏靶向中枢神经系统的高效性药物载体。细胞外囊泡(Extracellular vesicles, EVs)由于具有明显优势,已作为药物载体得到了广泛的应用。然而,由于其靶向性不足和全身给药后的“稀释效应”,临床应用受到限制。
近日,来自宁夏医科大学总医院王立斌教授课题组和陕西师范大学李星教授课题组的研究人员在Biomaterials Science上发表题为“EncapsulateBryostatin-1 by targeted exosomes enhances remyelination and neuroprotectioneffects of cuprizone induced demyelinating animal model of multiple sclerosis”(DOI:10.1039/d1bm01142a)的研究论文。该研究在铜腙喂食的毒性脱髓鞘动物模型中,通过修饰外泌体使其具有显著的靶向CNS病灶部位的能力,为CNS脱髓鞘疾病以及神经炎症提供了一种有效的治疗策略。宁夏医科大学总医院吴晓玉、陕西师范大学廖宝莹和空军军医大学肖丹等为论文的共同第一作者。

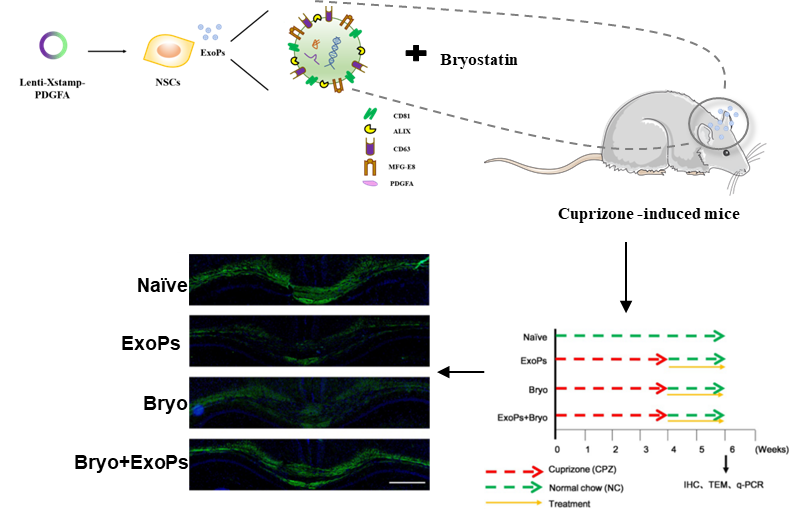
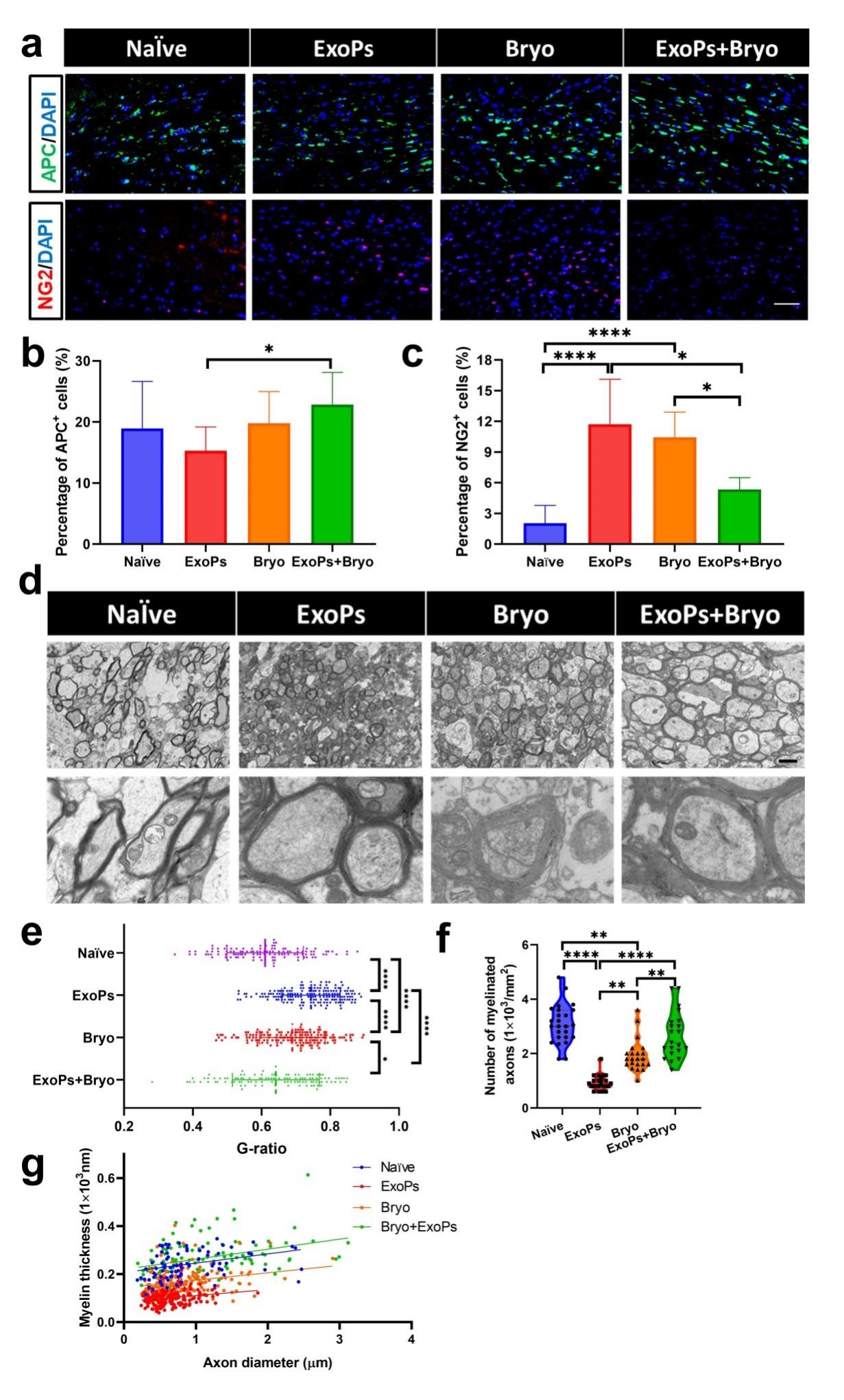
图1 靶向性外泌体负载药物治疗脱髓鞘动物模型示意图在该研究中,研究者首先验证了脱髓鞘病灶处的病理特点,发现少突胶质前体细胞表面受体异常表达,可作为外泌体的靶向结合位点。前期研究结果表明外泌体本身可以到达CNS区域,但被髓鞘形成的前体细胞——少突胶质祖细胞摄取的效率较低。因此,研究者们使用了外泌体靶向修饰技术,通过分子生物学的方法将候选配体PDGFA融合在外泌体膜表面 MFG-E8(Milk FatGlobule-Epidermal Growth Factor 8)蛋白上,从而提高了修饰后外泌体的靶向效率。随后研究人员从细胞和动物水平检测了靶向性外泌体对不同类型神经细胞的靶向能力。结果均表明,选择PDGFA(DGFRa的配体)作为PDGFRa+ OPC细胞的靶向配体适用于铜腙诱导的脱髓鞘动物模型,并且该外泌体具有穿越血脑屏障靶向大脑病灶区域的能力。随后,研究者利用该靶向外泌体携带神经保护药物苔藓抑素,观察其对脱髓鞘疾病的作用。在铜腙诱导的脱髓鞘动物模型中,载药的靶向性外泌体能够明显提升少突胶质细胞的数量,减少胶质细胞的增生以及神经元的损伤,并更加有效的促进髓鞘再生。 Encapsulation ofbryostatin-1 by targeted exosomes enhances remyelination and neuroprotectioneffects in the cuprizone-induced demyelinating animal model of multiplesclerosis. Biomat Sci, 2021, Dec 20. doi: 10.1039/d1bm01142a.外泌体资讯网 Biomaterials Science:靶向性外泌体负载苔藓抑素治疗脱髓鞘动物模型并促进髓鞘再生的作用研究