大多数身体机能的控制取决于细胞间相互交交流的能力。我们早就知道细胞间通讯的两种途径:神经系统和激素分泌。在过去的五年里,科学家们认识到基于外泌体的第三种重要的交流途径——含有蛋白质和RNA分子的微小囊泡,从细胞分泌到循环中,在那里外泌体可以被其他细胞吸收并调节新陈代谢。
许多实验室都专注于研究携带microRNA的外泌体。microRNA是非常短的RNA,具有调节其他较长的RNA的能力,这些RNA制造不同的细胞蛋白质并控制细胞功能。因此,microRNA影响健康和疾病中细胞行为的许多方面。
Joslin糖尿病中心的科学家们现在已经发现了细胞如何为它们的分泌外泌体挑选一组自己的microRNA——哈佛医学院医学教授C. Ronald Kahn说。
“我们的工作提供了对这种新的细胞通讯机制的重要见解,因为它打破了细胞为何分泌microRNA以及为什么它们保留了一些microRNA的密码。”描述这项工作的Nature杂志论文的通讯作者Kahn说。
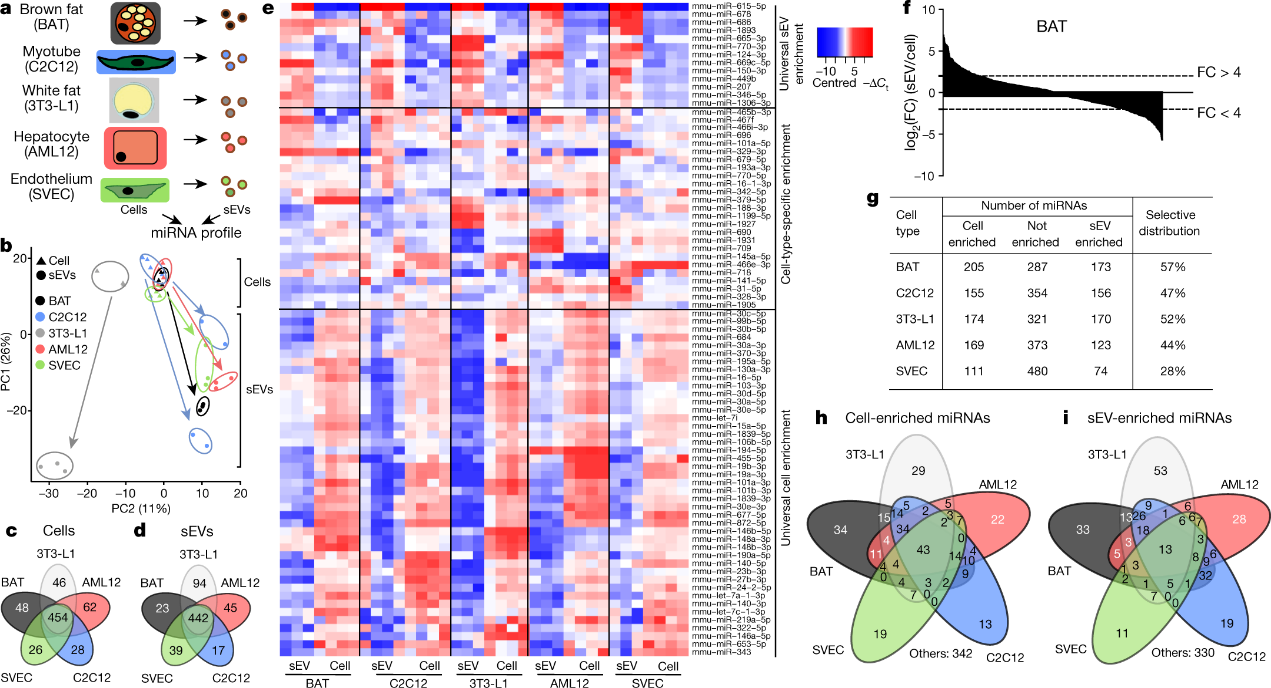
Kahn和他的同事开始为参与新陈代谢的五种细胞(棕色脂肪、白色脂肪、骨骼肌、肝脏和血管内皮细胞)建立组织培养,来检测这些细胞将哪些microRNA选入了外泌体。
生物学家发现,这些不同类型的细胞在其外泌体中具有完全不同的microRNA集合。
“虽然一些microRNA由所有细胞类型都会分泌,”Kahn说,“但许多microRNA仅由这些细胞类型中的一种或两种分泌,即使这些RNA在其他细胞类型里也有。”
图:sEV和细胞中的细胞类型特异性miRNA,以及sEV的选择性与某些miRNA的细胞分布。a,本研究中使用的实验装置和细胞系。b,PCA显示了每种细胞类型(n =3-4)的细胞和sEV的miRNA谱。c,维恩图显示了每种细胞类型的细胞体中特异性表达的miRNA的数量。d,维恩图显示了在每种细胞类型的sEV中具有特定表达的miRNA的数量。e,热图显示了所研究的每种细胞类型的sEV和细胞体中指定miRNA的丰度。f,瀑布图显示了棕色脂肪细胞中表达的所有miRNA的sEV富集。g, 表格显示了每种细胞类型的细胞体或sEV富集或没有富集的miRNA数量。最后一列表示具有选择性分布的miRNA的百分比。h,维恩图表明与其各自的sEV相比,细胞体中显著富集的miRNA的数量。i,维恩图表明与每种细胞类型及其组合的各自细胞体相比,sEVs中显著富集的miRNAs的数量。
“在某些情况下,外泌体中的microRNA浓度是细胞中的80倍,”Kahn说,“其他 microRNA 在细胞中的浓度是它们在外泌体中的10或20倍。”
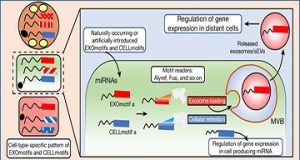
为了了解这是如何发生的,该团队在microRNA中寻找非常短的基因序列“基序”,这些基因序列可能会使microRNA或多或少地被分泌到外泌体中。研究人员发现,这五种细胞类型中的每一种都在这个过程中使用了不同的序列基序。一般来说,每种细胞类型都使用这些序列基序来确定细胞更喜欢分泌哪些microRNA以及想要保留哪些microRNA。
为了验证这些发现,Joslin的研究人员对microRNA序列基序进行了基因改造,以查看这些改变是否会改变通常会被保留而不是分泌的microRNA,反之亦然。
“我们证明这些基序不仅存在,而且可以被操纵并改变 microRNA 去向的行为。”Kahn说,“总的来说,这些在外泌体microRNA编码方面的发现确实跨越了研究的各个领域。”
早在2017年,Kahn实验室就表明脂肪组织是含有microRNA的外泌体的主要来源,并且这些在血液中循环的microRNA可以调节肝脏处理葡萄糖和代谢的很多方面。
在他们最新的论文中,Kahn和他的同事表明,修改来自脂肪的microRNA中的序列基序可以增加外泌体RNA被脂肪分泌、被肝脏吸收并调节肝脏代谢的能力。
Kahn的团队现在正在研究在外泌体中操纵microRNA基序是否可以改善糖尿病和其他代谢疾病的基因治疗。
“有了这些新发现,我们可以对容易进入皮下脂肪中的microRNA进行基因操作,以改善肝脏的新陈代谢,因为我们取出脂肪比较容易,而取出肝脏是不现实的。”“总的来说,我们所做的从根本上来说不仅局限于糖尿病代谢领域,因为我们确定这种方法现在可以应用于其他细胞类型,包括大脑、胰腺、肾脏或其他组织中的细胞。”Kahn说。
外泌体资讯网 Nature杂志的新研究破解了细胞间外泌体传输系统的密码