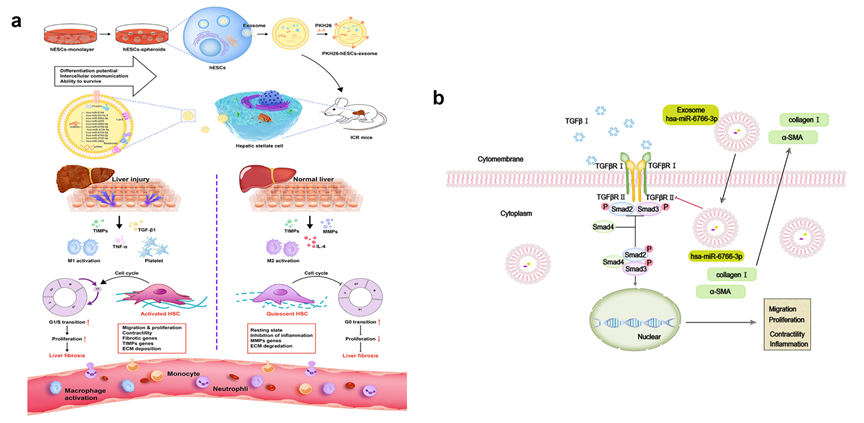
肝纤维化是肝癌发生的主要危险因素之一,当肝纤维化导致晚期肝硬化时,需要进行肝移植,而干细胞分泌的外泌体对纤维化的缓解发挥着有益的作用。最近的研究表明,胚胎干细胞衍生的外泌体(hESC-exosomes)具有显著的组织修复的能力,但是其在肝纤维化的治疗中是否有效仍然未知。近日,来自华南理工大学段玉友团队的研究人员发现肝星状细胞的活化在肝纤维化的发病机制中起着至关重要的作用,而抑制肝星状细胞的激活在一定程度上可以改善肝纤维化。相关研究成果以“为题发表做国际杂志Journal of nanobiotechnology上(2021 Dec 20;19(1):437)。与二维(2D)培养的细胞相比,三维(3D)细胞球体的生理状态更像体内的细胞,因此其临床和生物学意义更大,具有更高的再生潜力。通过收集来自3D培养的人胚胎干细胞(3D hESC)和2D单层培养的人胚胎干细胞(2D hESC)来源的外泌体(exosomes),研究者比较了其在体外和体内对纤维化肝的治疗潜力。在体外,PKH26标记的hESC-exosomes被证明可以被内吞到TGFβ活化的肝星状细胞系LX2细胞中,并减少纤维原性标志物的表达,从而调节细胞表型。双光子(TPEF)成像显示,PKH26标记的3D hESC-exosomes在肝脏中积累能力增强,在纤维化小鼠模型中表现出更显著的治疗效果。同时,3D hESC-exosomes可降低纤维原性标志物和肝损伤标志物的表达,改善肝功能蛋白水平,最终恢复纤维化小鼠的肝功能。 机制研究发现,miRNA微阵列显示miR-6766-3p在3D hESC-exosomes中显著富集,通过生物信息学和双荧光素结合实验,研究者预测并证实TGFβRII是miR-6766-3p的下游靶基因。此外,miR-6766-3p可有效降低活化LX2细胞的增殖、趋化以及促纤维化作用。进一步研究发现miR-6766-3p也可显著下调靶基因TGFβRII及其下游SMADs蛋白,尤其是磷酸化蛋白p-SMAD2/3的表达。以上研究结果表明,3D hESC-exosomes中的miR-6766-3p通过抑制TGFβRII的表达来失活SMADs信号,从而减弱LX2细胞的激活并进一步抑制肝纤维化,提示miR-6766-3p有可能成为抗纤维化的新型治疗药物以及疗效预测标记物。3D hESC exosomesenriched with miR-6766-3p ameliorates liver fibrosis by attenuating activatedstellate cells through targeting the TGFβRII-SMADS pathway. JNanobiotechnol, 2021, 20;19(1):437.外泌体资讯网 3D培养人胚胎干细胞衍生的外泌体能有效抑制肝脏星状细胞的活化,从而改善肝纤维化