“牙疼不是病,疼起来要人命”是老百姓对“牙病”最初的认识,而“牙疼”的罪魁祸首就是“牙髓炎”。目前,针对于牙髓炎的治疗方式主要是以机械清创为主的根管治疗,虽可终止疾病发展、消除炎症,但无法保留和再生牙髓的功能。随着对组织再生机制研究的深入,学者们发现干细胞分泌的外泌体在组织再生中发挥着与干细胞相似的作用,而基于干细胞外泌体的牙髓组织再生治疗已成为实现牙髓再生的新方式。
近日,由四川大学华西口腔医学院田卫东教授领衔的牙再生研究团队利用超速离心的方法成功提取了来自牙髓组织分泌的外泌体(以下称为“牙髓组织外泌体”,英文缩写“DPT-exos”),并结合支架材料在动物体内开展了牙髓组织再生的探索。相关论文“The Application of Pulp Tissue Derived-Exosomes in Pulp Regeneration:A Novel Cell-Homing Approach”在International Journal of Nanomedicine杂志上发表(2022,29;17:465-476),四川大学华西口腔医学院的田卫东教授和杨波讲师为文章的共同通讯作者,2017级硕士陈彦及2013级八年制博士马悦为本文的共同第一作者。
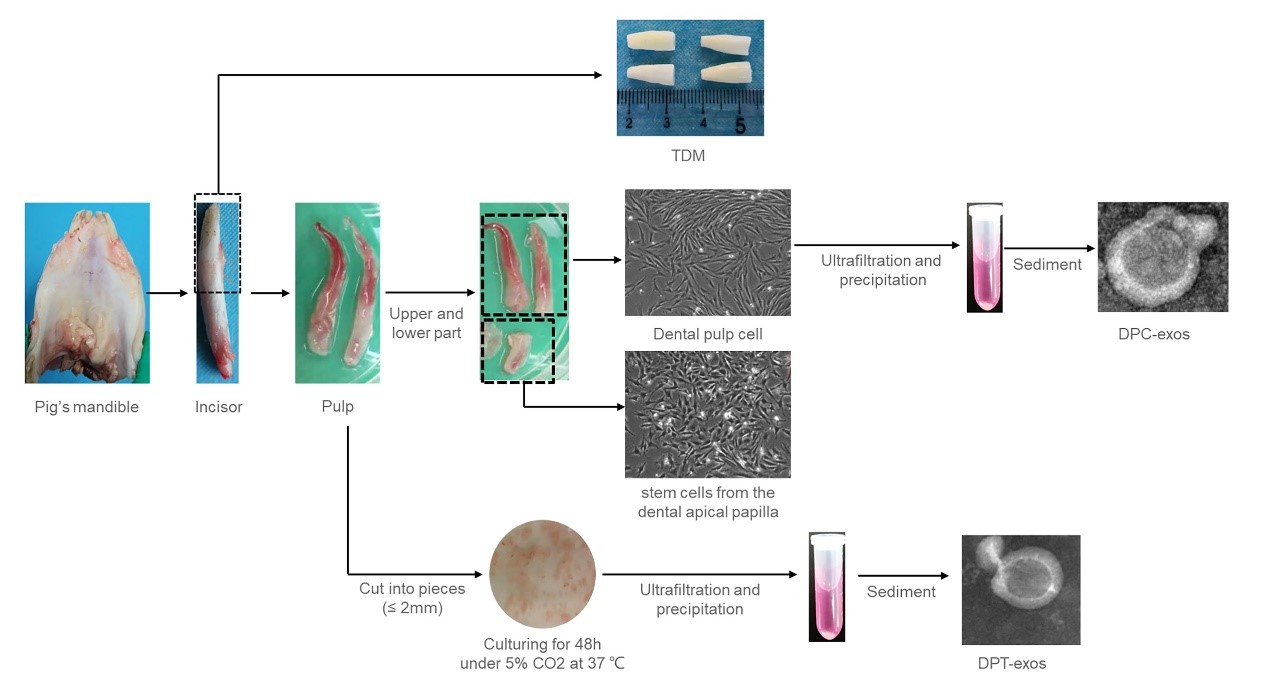
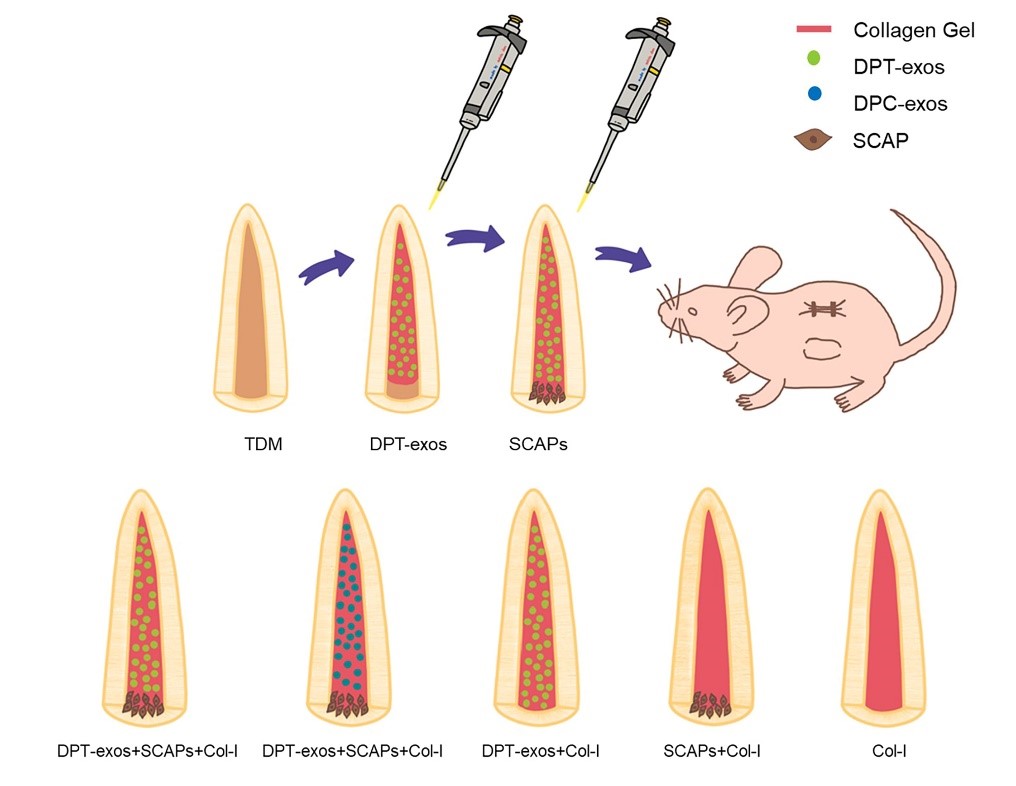
该研究的总体思路(图1)是利用牙髓组织中外泌体的组织特异性诱导作用及牙髓再生微环境(脱矿牙本质基质,Treated dentin matrix, TDM)的构建,明确外泌体能否诱导根尖区牙乳头干细胞(SCAP)牙向分化及再生牙髓组织的可行性。
图1.研究思路及实验分组
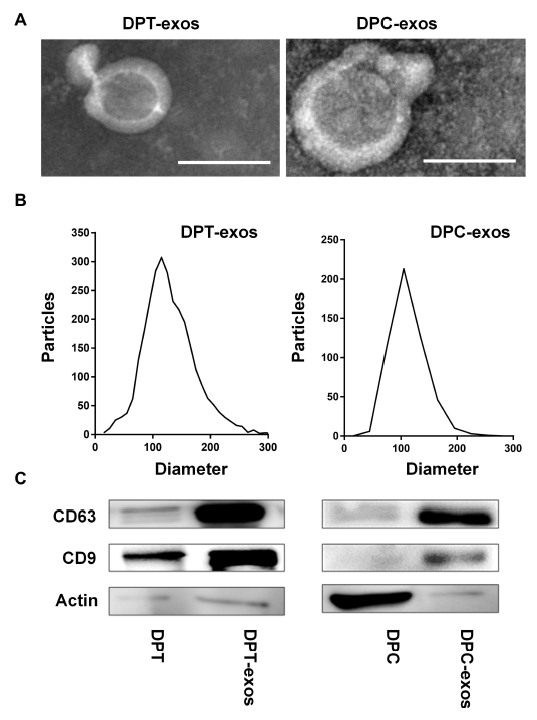
研究人员首先比较了牙髓组织来源的外泌体(DPT-exos)及牙髓细胞来源的外泌体(DPC-exos)的形态表征、物理特性:在电镜下观察到两种外泌体呈典型的茶托样结构(图2A),动态光散射(DLS)检测显示两种外泌体直径都分布于100-150nm之间(图2B),免疫印迹(WB)结果表明两种外泌体都表达特定的表面标记物(CD63、CD9)(图2C),这一结果证实了本研究中的两种外泌体符合外泌体的基本特征。
图2. DPT-exos和DPC-exos的鉴定
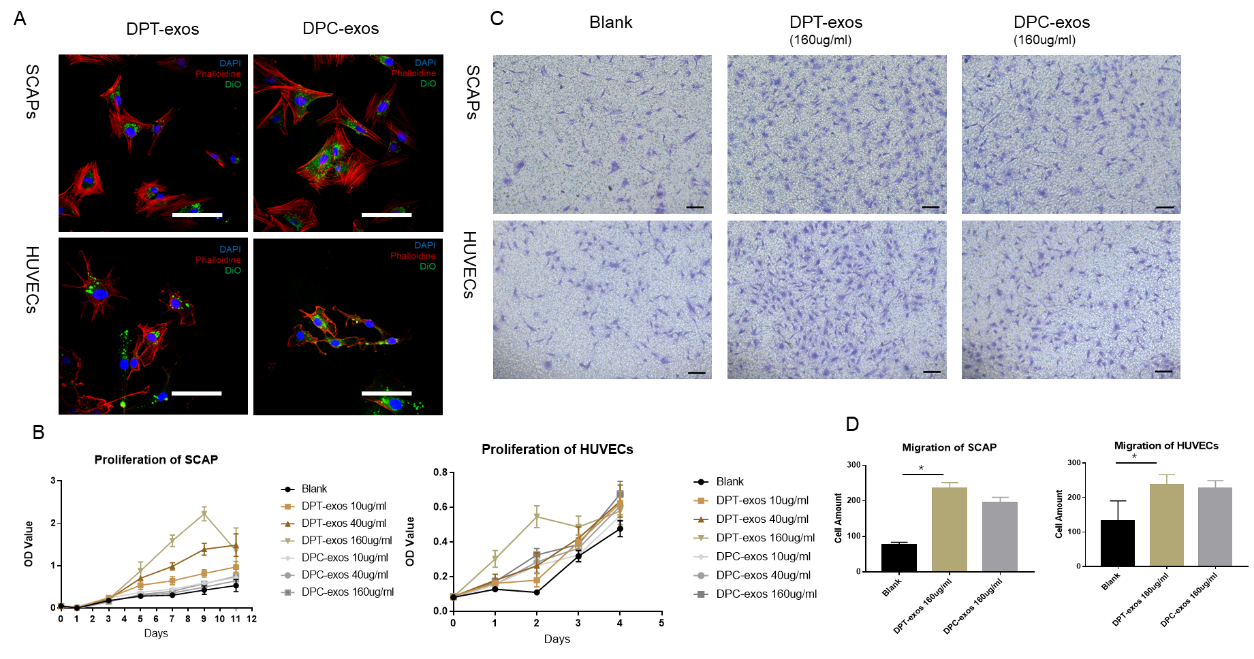
随后,研究人员对两种不同来源的外泌体在促进细胞增殖和迁移的特性进行了研究:将两种外泌体分别与根尖乳头干细胞(SCAPs)和人脐静脉内皮细胞(HUVECs)共培养,通过共聚焦显微镜观察到标记后的两种外泌体能被两种细胞摄取并分布于胞内(图3A)。同时利用CCK-8试剂盒与Transwell培养板分别检测两种外泌体对两种细胞增殖和迁移的影响,结果显示两种外泌体都能促进两种细胞的增殖和迁移,其中,DPT-exos较DPC-exos具有更强的促进作用(图3B-D)。
图3. DPT-exos和DPC-exos对两种细胞增殖和迁移的影响
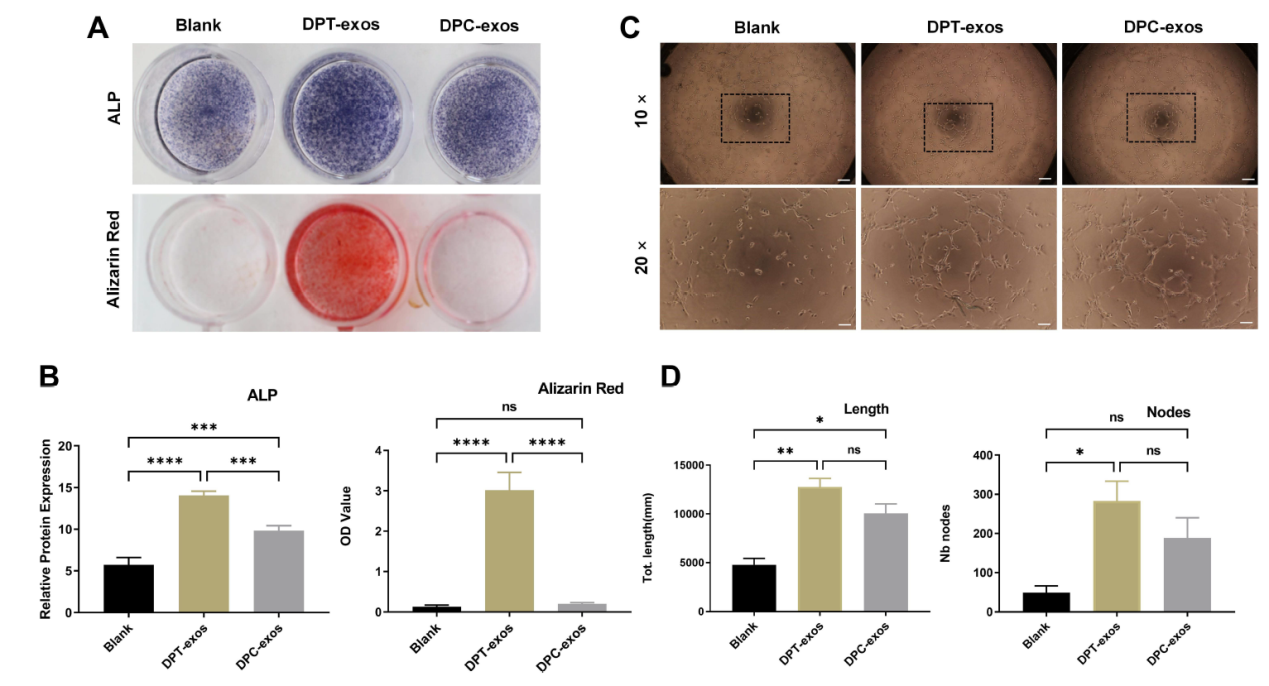
牙髓组织再生的关键在于矿化牙本质和血管的再生,该研究进一步在体外分别检测了两种外泌体的促进矿化和血管再生的能力。结果显示DPT-exos较DPC-exos具有更强的促进SCAPs的矿化能力(图4A-B)和促进HUVECs的成血管作用(图4C-D),提示DPT-exos具有更强的促进牙髓再生的潜能。
图4.DPT-exos和DPC-exos促进矿化和成血管
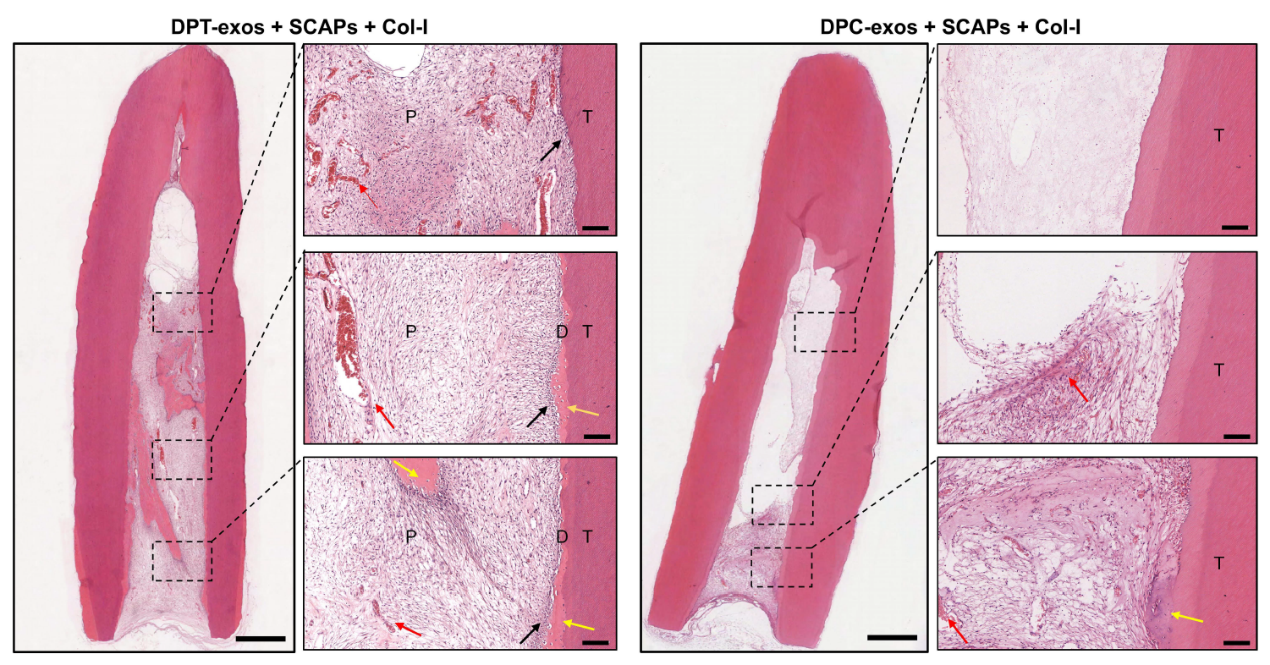
随后,研究人员构建了以“细胞归巢”再生牙髓的动物模型,发现:DPT-exos相较于DPC-exos能明显地促进根尖部的SCAPs迁移进入牙本质套管中并形成牙髓样组织,在DPT-exos组中,观察到有新生牙本质样组织生成和成牙本质样细胞的极性分布,髓核中相较于DPC-exos组具有更密集的血管分布和胶原沉积(图5)。
图5.DPT-exos诱导SCAPs在牙本质套管中再生出牙髓样组织
以上结果表明DPT-exos与DPC-exos均可通过诱导根尖部SCAPs迁移进入TDM支架材料中再生出牙髓样组织,但从组织结构和形态方面DPT-exos具有更明显的再生优势。
综上所述,该研究首次利用牙髓组织成功提取了牙髓组织分泌的外泌体,利用组织工程技术再生出了具有组织学结构特性的牙髓样组织,明确了牙髓组织外泌体用于牙髓组织再生具有可行性,为牙髓组织再生及牙髓病的治疗提供了新的思路和治疗策略。
参考文献:
The application of pulp tissue derived-exosomesin pulp regeneration: a novel cell-homing approach. International Journal of Nanomedicine. 2022, 29; 17:465-476.doi: 10.2147/IJN.S342685. eCollection 2022.