作为最有效的抗原呈递细胞(APC),树突状细胞(DCs)是启动和调节肿瘤微环境中先天免疫和适应性免疫的核心。自2010年美国FDA批准首个DC疫苗PROVENGE用于晚期前列腺癌治疗以来,目前多种以DC细胞为靶标的DC疫苗已进入III期临床试验,靶向应用于胶质母细胞瘤、肾癌和黑色素瘤等多种恶性肿瘤的治疗。然而,免疫优势抗原/佐剂的选择、体外制备流程的标准化、全身性炎症反应等均是阻碍DC疫苗走向临床的难点。
近年来,因具有低免疫原性(可用于同种异体治疗),低毒性、可提高药物的生物利用度以及出色的靶向归巢属性等诸多优势,外泌体(Exosome)作为一种“天然纳米运输材料” 开始受到广泛关注,已被应用于慢性肾病、非小细胞肺癌、结肠癌、类风湿性关节炎和新冠等多种疾病的治疗中。因此,肿瘤来源的外泌体可用作无细胞治疗载体,以浸润肿瘤微环境(TME)用于DC的激活。

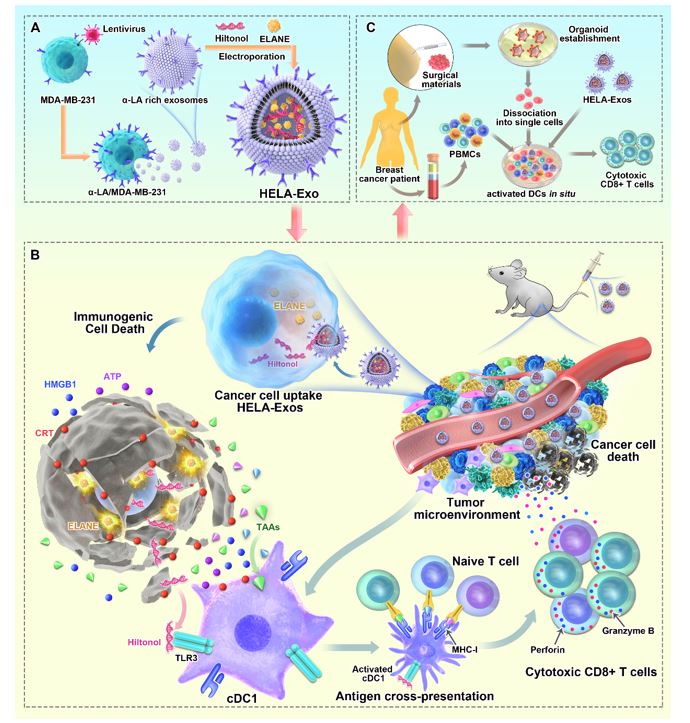
图1.HELA-Exos抗肿瘤效应模式图
ICD可显著增强抗原暴露,介导释放肿瘤细胞内的免疫激活分子,并促进DC细胞吞噬死亡的肿瘤细胞。因具有这些优势,ICD诱导剂已经被美国FDA批准用于自体回输DC疫苗全细胞裂解抗原的制备,并且首款ICD诱导剂鲁比卡丁已于2020年6月15日获美国FDA批准应用于转移性肺癌治疗。因此,在肿瘤细胞中诱导ICD将是维持DC充分暴露于肿瘤抗原并绕过DC疫苗需鉴定最佳免疫显性抗原的有效方法。
然而,DC通常在肿瘤微环境中表现出较差的成熟度,在呈递肿瘤抗原方面效果较差。采用佐剂激活DC是DC疫苗制备的重要途径之一,其中TLR3激动剂YS-ON-001已获美国FDA肝细胞癌和胰腺癌的孤儿药资格,并于2021年12月9日在国内医院开展晚期乳腺癌、晚期肺癌、晚期肝癌和晚期黑色素瘤的I期临床试验。
因此,这种基于无细胞外泌体的TLR3激动剂与ICD诱导剂的组合,为设计用于乳腺癌治疗的DC疫苗提供了强大而新颖的开发平台。
参考文献:
Engineered exosomes as an in situ DC-primed vaccine to boostantitumor immunity in breast cancer, Mol Cancer. 2022, 11;21(1):45. doi:10.1186/s12943-022-01515-x.
外泌体资讯网 Molecular cancer | 武汉大学中南医院汪付兵团队:工程化外泌体作为DC原位疫苗增强乳腺癌的抗肿瘤免疫力