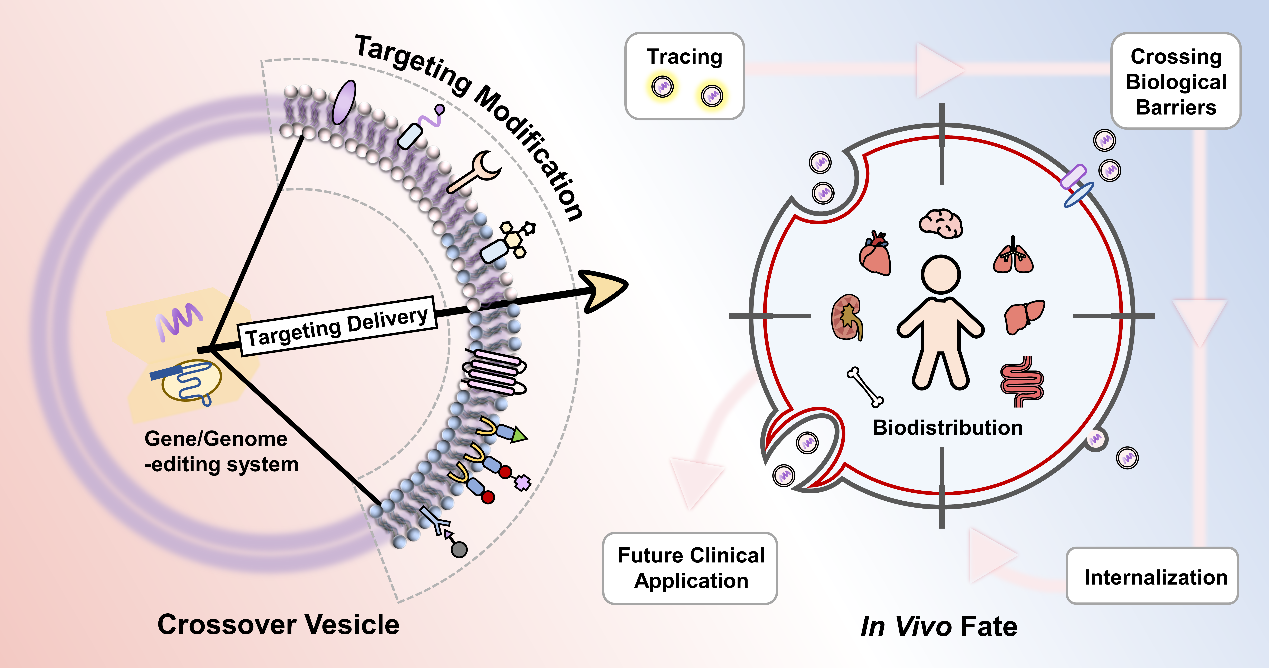
随着基因疗法的发展,如何突破生物屏障,实现基因精准靶向递送,同时确保基因在递送过程中的稳定性,避免体内以及胞内微环境对核酸分子或基因组编辑系统的破坏和干扰,成为基因治疗中需要重点关注的难题。近年来,外泌体及以及仿生囊泡这类“跨界”囊泡受到越来越多关注,在基因治疗领域被广泛研究,其在体内的命运和靶向工程化的研究进展也备受关注。
近日,来自浙江大学药学院的高建青团队的研究人员在药剂学权威综述期刊Advanced Drug Delivery Reviews杂志上发表“Thein vivo fate and targeting engineering of crossover vesicle-based gene delivery system”综述 (2022 May 28:114324),对这类“跨界”囊泡的基因携载、体内命运和靶向修饰等方面的研究进行了梳理和总结。文章的通讯作者为浙江大学药学院高建青教授,第一作者为浙江大学药学院蒋心驰博士。
外泌体是一种尺寸在30-150 nm的天然囊泡,可以由各种细胞生产并释放。外泌体富含多种来自其亲代细胞的蛋白质、核酸和脂质,具有天然功能。仿生囊泡是裂解细胞形成的纳米尺寸囊泡,或是将细胞膜与人工材料相结合,制备得到的新型混合囊泡。外泌体和仿生囊泡均继承了其来源细胞的多种生物功能,比如在血流中的稳定性、免疫隐形能力、固有的靶向特性、跨越生物屏障的能力等。但相较于细胞这类“活载体”,其结构与功能得到了极大的简化,与人工合成载体有一定相似性,从而在制备、载药、运输、应用等方面具有特殊的优势。这种兼具了天然生物囊泡和人工合成囊泡优势的“跨界”特点有利于基因药物在体内的有效递送。
图1. “跨界”囊泡携载并递送基因/基因组编辑系统
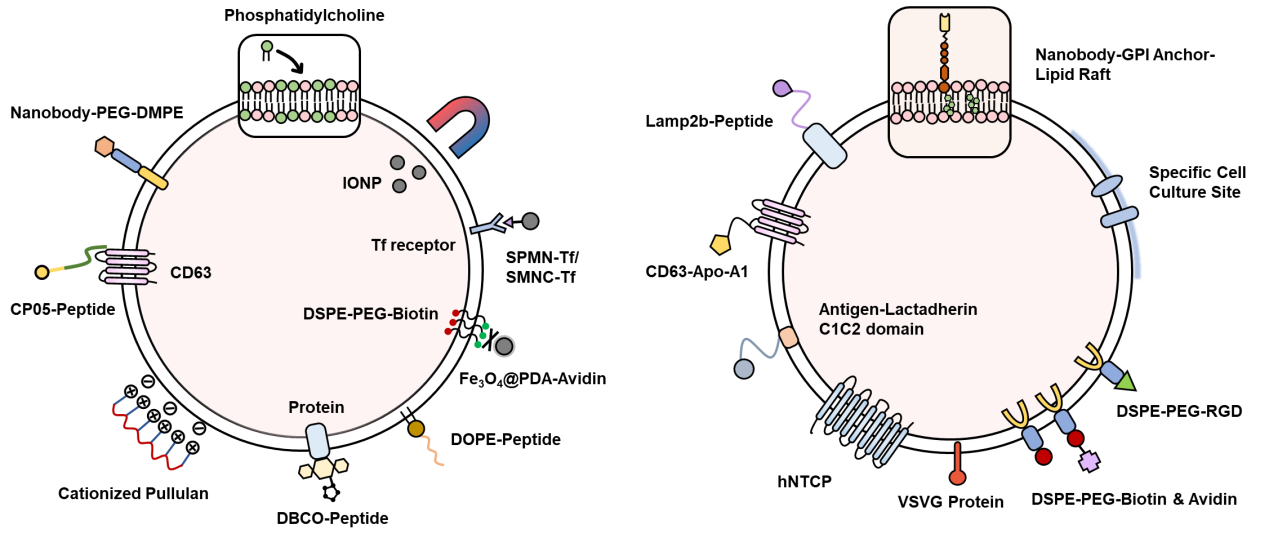
这篇综述对于核酸药物和以CRISPR/Cas9为代表的基因编辑系统如何通过跨界囊泡进行装载以及体内靶向递送进行介绍。跨界囊泡可以携载基因药物,在体内克服诸如致密组织、血脑屏障、肠道粘膜等生物屏障的限制,实现靶向定位和深入穿透,继而被靶细胞摄取,实现基因递送治疗。跨界囊泡的天然靶向能力会受其粒径、电位、膜表面蛋白、给药途径等因素的影响。同时,因为跨界囊泡的“跨界”特点,对于脂质体的靶向修饰方法,以及对于其来源细胞的工程化改造均能为其提供有效的修饰技术,并可成功加强其靶向传递基因药物的能力。当然,跨界囊泡距离应用还存在诸多挑战,比如产量、质控、储存问题等,而层出不穷的新研究也昭示着这类新兴载体将与基因传递系统的发展共同进步,一起走向更广阔的应用前景。
图2. “跨界”囊泡靶向修饰
高建青教授致力于基于干细胞的生物载体靶向递送系统研究,在Sci. Adv.、Adv. Mater.、ACS Nano、Adv Funct Mater.、J. Control. Release等期刊持续发表研究成果。近年来,课题组在干细胞来源外泌体用于脊髓损伤治疗(Nano Lett. 2020,20(6):4298-4305; Asian J Pharm Sci. 2021,16(6):806-815;Biomater Sci. 2022,10(7):1803-1811),以及干细胞膜仿生囊泡用于缺血性脑卒中治疗(Adv Funct Mater.2020,30(49):2006169.)等领域取得了多项进展。
该工作得到了国家自然科学基金重点国际(地区)合作研究项目、国家自然科学基金青年项目、浙江省自然科学基金重大项目、浙江省自然科学基金探索项目、中国博士后基金面上项目等资助。
参考文献:
The in vivo fate and targeting engineering of crossover vesicle-based gene delivery system. Adv Drug Deliver Rev. 2022;114324.
外泌体资讯网 <综述> Adv Drug Deliver Rev|浙江大学药学院的高建青团队:基于跨界囊泡的基因递送系统的体内命运和靶向工程化