慢性呼吸系统疾病是全球最主要的死亡原因之一,此外,由SARS-CoV-2引起的2019年冠状病毒病(COVID-19)大流行进一步促使呼吸系统疾病成为全球发病率和死亡率的最主要原因。2020年12月,辉瑞-生物技术公司和Moderna公司的基于脂质纳米颗粒的COVID-19 mRNA疫苗先后获得批准,在全球范围内被应用于预防COVID-19。由于两种疫苗都采用了基于脂质纳米颗粒的mRNA疫苗技术,对冷链运输及低温存储条件均提出严苛的要求。其中Moderna疫苗在标准冷藏温度2-8℃环境中能存放30天;而辉瑞公司疫苗对温度的要求更高,运输环节需保证零下70℃的超低温环境,在普通冷藏温度中仅能存放5天。部分偏远地区和发展中国家难以负担昂贵的冷链运输及超低温存储条件,面临巨大的经济压力。此外,目前的mRNA疫苗均需要专业医护人员进行肌肉注射,对操作人员职业技能及注射环境有较高要求,进一步限制了基于脂质纳米颗粒的mRNA疫苗在全球范围内的广泛应用。同时,经由肌肉注射的mRNA疫苗主要通过诱导体液免疫发挥作用,限制了其在预防主要通过飞沫经由呼吸道传播、以肺为主要受累器官的传染性疾病中的生物利用度。因此,研发可满足室温储存运输、吸入给药、稳定安全的新冠候选疫苗是解决上述问题的不二方案。就在一周前,北卡罗莱纳州立大学程柯教授团队发表了一种基于外泌体的、可雾化吸入的新冠疫苗,该疫苗由肺源性外泌体结合的重组新冠病毒受体结合域(RBD)组成。雾化吸入该外泌体介导的蛋白疫苗可以在激活体液免疫的同时,激活黏膜免疫及肺组织T细胞免疫,降低仓鼠病毒载量,减轻新冠病毒导致的肺组织损伤 (Nature Biomedical Engineering, 2022)[1]。在基于外泌体的重组蛋白疫苗取得初步成果后,该团队继续深入思考:1)是否可以制备基于外泌体的mRNA新冠疫苗?2)是否可以制备可直接吸入的冻干粉外泌体疫苗,避免冻干后再水化的过程,以最大程度的简化疫苗的接种方式?为了回答上述问题,2022年7月11日,程柯教授团队在Cell子刊Matter杂志上发表题为“Inhalable dry powder mRNA vaccine based on extracellular vesicles”的研究型论文,报道了一种基于外泌体的室温稳定型可吸入冻干粉mRNA疫苗 [2]。

该团队前期研究结果表明,与人工合成的脂质体(Lipo)或通用型细胞外泌体(HEK-Exo)相比,人肺球细胞来源的外泌体(Lung-Exo)在雾化吸入的递送方式上具有天然优势,可最大程度将mRNA及蛋白质递送至整个肺组织[3]。基于上述研究背景,该团队通过电穿孔法将编码新冠病毒刺突蛋白(Spike)的mRNA负载到Lung-Exo中并将其冻干,制备了基于Lung-Exo的mRNA疫苗冻干粉。结果表明,该外泌体mRNA疫苗冻干粉可在室温环境中至少稳定保存28天;同时,该外泌体mRNA疫苗经干粉吸入后,可均匀分布在非洲绿猴的呼吸道及肺泡上皮细胞中。干粉吸入2次后,该疫苗成功诱导小鼠呼吸道上皮细胞及肺泡细胞表达抗原蛋白,并激活其体液免疫及呼吸道黏膜免疫反应,产生抗原特异性的IgG及IgA抗体(图1)。
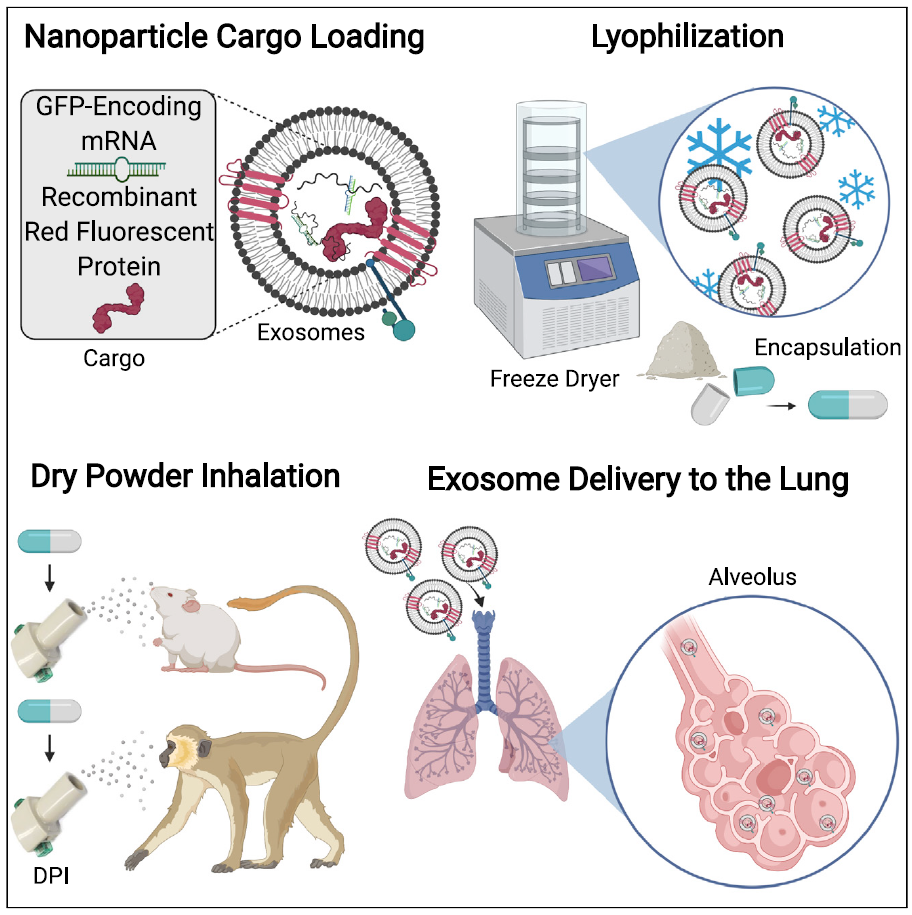
图1 | 基于外泌体的可吸入冻干粉mRNA疫苗的制备流程及应用示意图。在该研究中,作者首先对基于Lung-Exo的冻干粉递送蛋白和mRNA的稳定性进行了系统评估。为此,作者通过电穿孔法将编码绿色荧光蛋白(GFP)的mRNA和红色荧光蛋白(RFP)作为报告蛋白分别负载到Lung-Exo,HEK-Exo和Lipo中,并将其进一步制备为冻干粉。在室温存储28天后,仍有97.6%的货物被稳定包裹在外泌体中。原子力显微镜和透射电镜检测结果表明冻干及再水化的过程并不会影响外泌体的膜稳定性,仅外泌体的粒径稍有所增大。此外,体外成像结果证实了室温保存28天并不影响外泌体冻干粉高效的将其负载的蛋白质和mRNA递送至肺组织中(图2)。
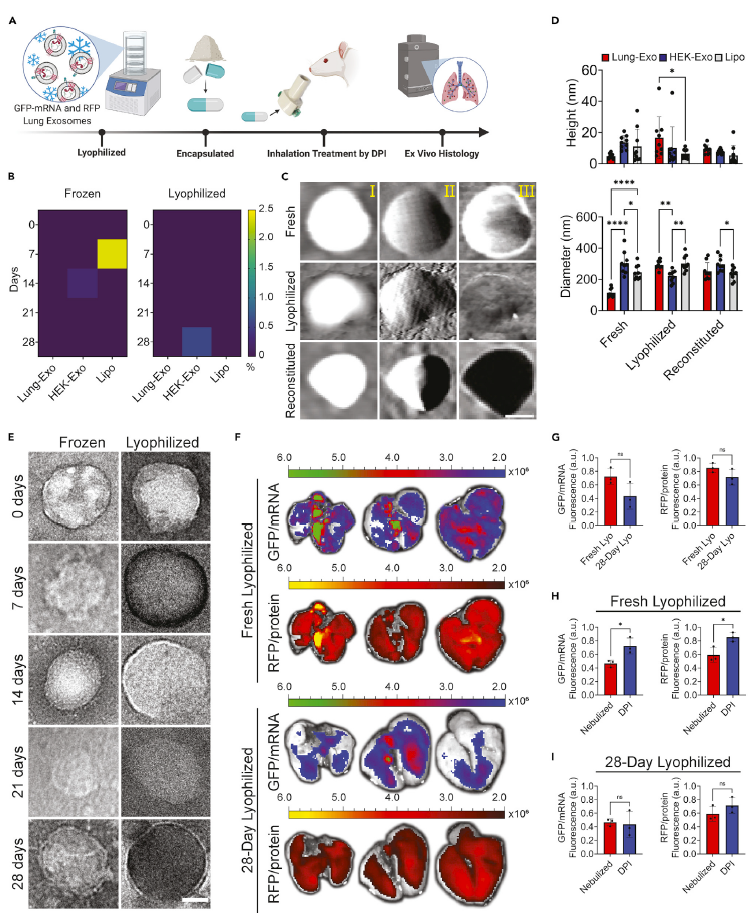
图2 |外泌体冻干粉递送蛋白和mRNA的稳定性评估。 (A) 外泌体冻干粉制备及在小鼠模型中干粉吸入给药示意图。(B) ELISA检测Lung-Exo, HEK-Exo, 及Lipo冻干粉的稳定性。(C, D) 原子力显微镜检测新鲜、冻干粉水化后的Lung-Exo, HEK-Exo, 及Lipo的形态变化和定量分析。(E) 液体冷冻和冻干粉状态下的Lung-Exo透射电镜图片。(F, G) 在吸入新鲜及室温存储28天的冻干粉外泌体后,离体肺组织GFP及RFP成像及定量分析。(H, I) 吸入雾化外泌体或冻干粉外泌体24小时后,离体肺组织中GFP和RFP荧光信号强度定量分析。为了进一步研究该冻干粉外泌体mRNA疫的可行性,作者将SARS-CoV-2抗原Spike蛋白的编码mRNA负载到Lung-Exo中,制备了COVID-19冻干粉外泌体mRNA疫苗。透射电镜和粒径分析结果显示,在室温储存28天后,该冻干粉外泌体mRNA疫苗仍保有外泌体的形态及粒径大小。吸入该冻干粉外泌体mRNA疫苗后,小鼠肺组织中成功表达Spike蛋白,并激活肺部细胞免疫及黏膜免疫,诱导产生了高含量的IgG抗体和IgA抗体(图3)。
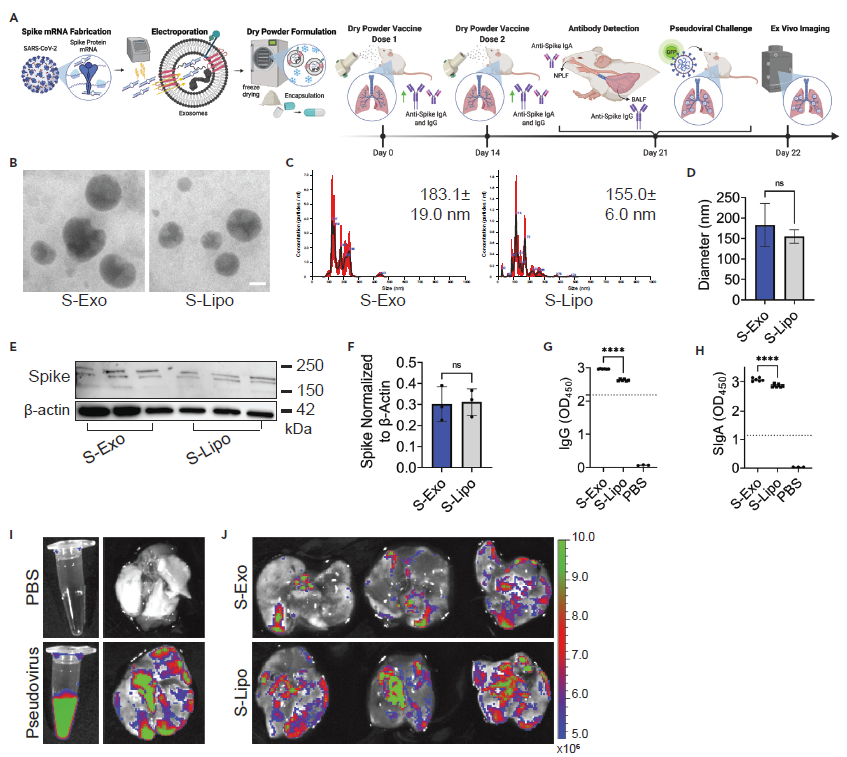
图3 | SARS-CoV-2抗原Spike蛋白编码mRNA负载的外泌体疫苗冻干粉高效激活免疫应答。(A)负载Spike蛋白编码mRNA的冻干粉外泌体mRNA疫苗的制备流程以及假病毒实验示意图。(B) 基于Lung-Exo和Lipo的冻干粉mRNA疫苗透射电镜图片。(C, D) NTA检测基于Lung-Exo和Lipo的冻干粉mRNA疫苗粒径分布。(E, F) 吸入基于Lung-Exo和Lipo的冻干粉mRNA疫苗后,肺组织裂解液中Spike蛋白免疫印迹及定量分析。(G) 小鼠肺泡灌洗液中IgG抗体滴度测定。(H) 小鼠鼻咽灌洗液中分泌型IgA抗体滴度测定。(I) PBS及GFP假病毒在溶液或离体肺组织中的成像图。(J)经Lung-Exo和Lipo冻干粉mRNA疫苗免疫的小鼠在吸入GFP假病毒24小时后肺组织中GFP信号。作为外泌体研究领域的领军人物,程柯教授致力于推动外泌体基础研究、临床应用及产业转化多个维度的共同发展。去年,程教授携手外泌体研究领域大牛Raghu Kalluri教授(细胞外囊泡行业巨头公司Codiak BioSciences科学创始人),共同创办了美国细胞外囊泡协会(American Association of Extracellular Vesicles , AAEV),并与与爱思唯尔出版公司合作创立了AAEV官方杂志Extracellular Vesicle(https://www.journals.elsevier.com/extracellular-vesicle),期望与领域内的各位科研工作者共同推进外泌体研究领域的发展与进步。

参考文献:[1] Wang, Z. et al. Exosomes decorated with a recombinant SARS-CoV-2 receptor-binding domain as an inhalable COVID-19 vaccine. Nature Biomedical Engineering, 2022. DOI: 10.1038/s41551-022-00902-5[2] Popowski, K.D., et al., Inhalable dry powder mRNA vaccine based on extracellular vesicles. Matter, 2022. DOI: 10.1016/j.vesic.2022.100002[3] Popowski, K.D., et al., Inhalable exosomes outperform liposomes as mRNA and protein drug carriers to the lung. Extracellular Vesicle, 2022. DOI: 10.1016/j.vesic.2022.100002
外泌体资讯网 刚发Nature BME, 再来Cell子刊Matter | 程柯教授团队:可吸入的外泌体冻干粉mRNA疫苗




