脊髓损伤等中枢神经系统疾病目前尚缺少有效的治疗手段。中枢神经组织的修复是当今医学的一大难题,而血管生成是组织修复过程中的重要和首要环节。干细胞疗法在组织和血管修复中显示了良好的前景,其中,多方面的证据显示间充质干细胞(MSC)可通过对微环境中的信息进行响应和反馈从而调节损伤组织的缺血微环境并最终促进组织修复。例如,损伤微环境中的血管内皮细胞可促进MSC成血管,将MSC与血管内皮细胞联合移植可增强其组织修复疗效。但血管内皮细胞的临床应用来源受限,并且,不像MSC具有低免疫原性,血管内皮细胞移植往往可产生免疫排异反应。
近日,浙江大学药学院高建青教授、韩旻副教授共同在ACS Nano杂志在线发表题为“Stimulation by Exosomes from Hypoxia Preconditioned Human Umbilical Vein Endothelial Cells Facilitates Mesenchymal Stem Cells Angiogenic Function for Spinal Cord Repair”的研究论文(doi: 10.1021/acsnano.2c02898)。该研究成功利用内皮细胞外泌体调控干细胞成血管并实现脊髓损伤后血管重建和组织修复。浙江大学药学院高建青教授和韩旻副教授为该研究论文的通讯作者,论文第一作者为浙江大学药学院博士后李黎明和博士生母佳富。
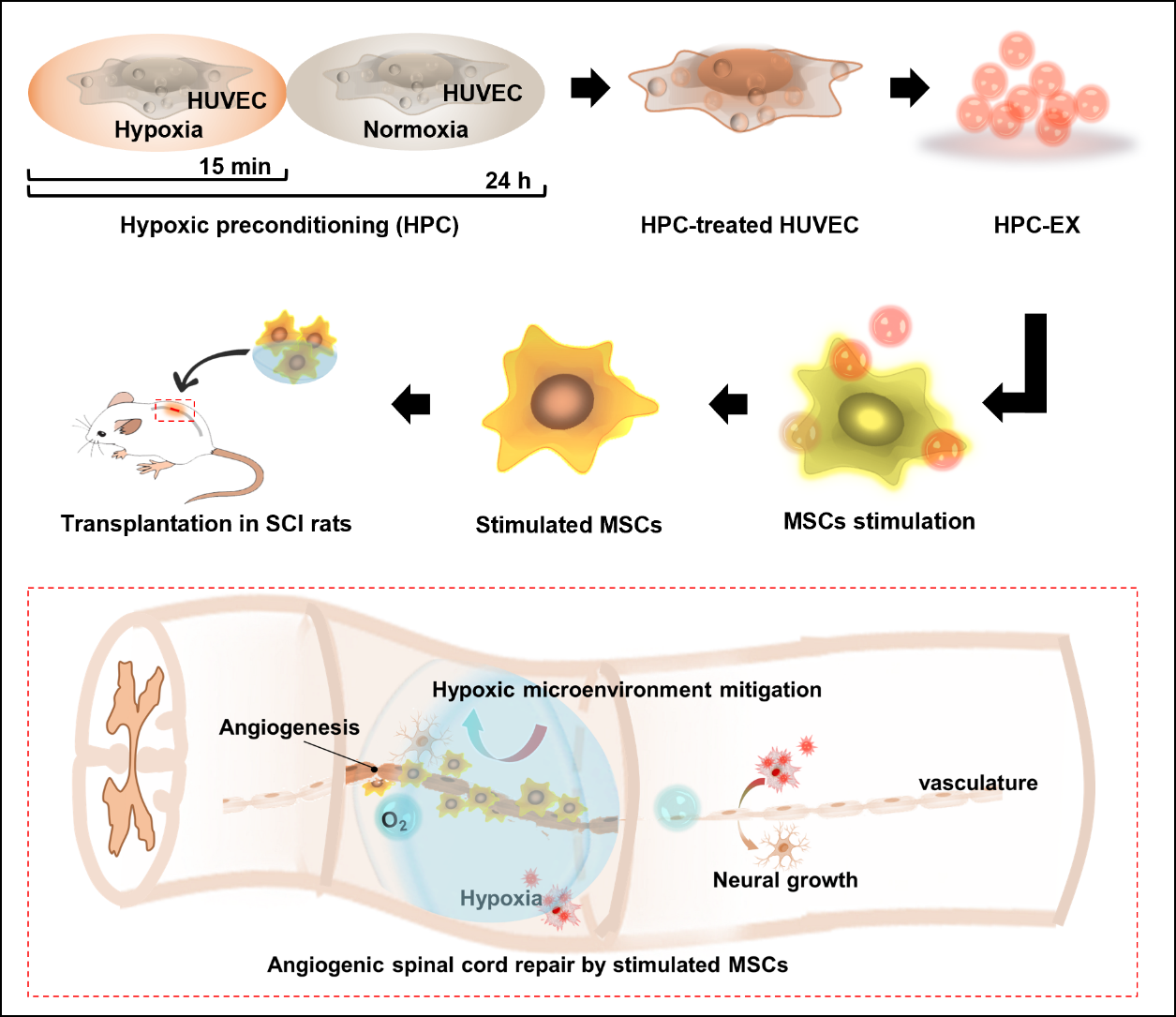
研究团队针对脊髓损伤的缺血微环境和成血管修复治疗,基于细胞外泌体在细胞-细胞交流与细胞-微环境交流中的作用,对人脐静脉血管内皮细胞(HUVEC)进行低氧预适应(HPC)刺激并获取其外泌体(HPC-EX),进一步利用该外泌体调控MSC细胞成血管并进行脊髓损伤治疗。每次HPC刺激由两个常氧-低氧的24小时培养循环组成,实验发现,在一个循环中包含仅15分钟低氧时长的HPC刺激即可使HUVEC产生有效促进MSC成血管的HPC-EX。摄取该HPC-EX的MSC于二维和三维培养条件下都可发生明显形态变化并形成管状结构,将与HPC-EX共孵育4小时的MSC转移到三维基质胶中后,MSC细胞在2小时内即可显著成管。这种由HPC刺激“激活”的HUVEC外泌体可明显促进MSC的迁移,检测发现,经HPC刺激后HUVEC外泌体中与促血管生成相关的因子(VEGFA, TGF-β1, FGF2, IL-1Ra)含量升高。将调控后的干细胞植入大鼠脊髓损伤部位进行神经修复治疗,有效促进了组织中血管生成,并同时改善炎症微环境,治疗最终促进了组织的修复和神经功能恢复。该项研究为脊髓损伤组织修复治疗提供了高效的促血管生成治疗策略,同时也为基于外泌体和干细胞的研究与疾病治疗提供了新的启发。研究受到科技部重点研发计划“人脐带间充质干细胞修复脊髓损伤的临床研究”的资助。
参考文献:Stimulation by Exosomes from Hypoxia Preconditioned Human Umbilical Vein Endothelial Cells Facilitates Mesenchymal Stem Cells Angiogenic Function for Spinal Cord Repair, ACS Nano. 2022 Jul 5. doi: 10.1021/acsnano.2c02898.
外泌体资讯网 ACS Nano | 浙江大学药学院高建青教授与韩旻副教授团队:低氧处理的细胞外囊泡调节间充质干细胞成血管和脊髓修复





