肿瘤表达的PD-L1用作评估对免疫疗法的治疗反应的生物标志物,但目前仍然缺少可靠的PD-L1检测方法。此外,虽然表达PD-L1的循环肿瘤细胞 (CTC) 和肿瘤衍生的外泌体可用作生物标志物,但目前CTC和外泌体的检测在临床上的敏感性和特异性非常低。来自美国威斯康星大学麦迪逊分校和韩国仁荷大学的研究人员开发了一种新的基于肽的PD-L1捕获技术,有效地从人血液中分离出表达PD-L1的CTC和外泌体,用于监测对肿瘤免疫疗法的治疗反应。相关成果以“Bimodal liquid biopsy for cancer immunotherapy based on peptide engineering and nanoscale analysis”为题在Biosensors and Bioelectronics杂志上出版发表,预计将于今年10月出版。
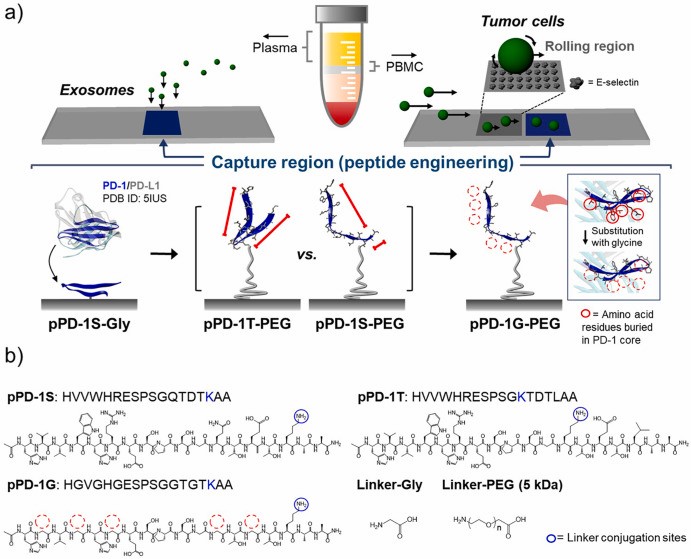
基于免疫检查点抑制剂的肿瘤免疫治疗在近年来取的了巨大的成功,比如靶向PD-1及其配体PD-L1已经广泛用于临床实践。尽管PD-1/PD-L1拮抗剂在多种肿瘤类型中表现出持久的反应,但该疗法仅对10-40%的肿瘤患者有效,这种应用限制导致临床上迫切需要一种能够预测和监测治疗反应的生物标志物。根据临床数据,肿瘤中的PD-L1 表达被认为是一种很好的预测性生物标志物,并且已被用于评估针对PD-1/PD-L1 通路的免疫疗法的治疗反应。例如PD-L1表达与PD-1/PD-L1拮抗剂在非小细胞肺癌患者中的疗效密切相关。尽管PD-L1具有作为生物标志物的潜力,但目前对PD-L1检测仍然存在障碍。活检标本中PD-L1的免疫组织化学检测是目前的金标准,但这仅仅能检测取材部位的PD-L1表达,由于肿瘤异质性的存在,这不能反映整体肿瘤的表达状态。作为替代方案,液体活检已成为一种有效的实时监测技术,用于监测治疗反应和肿瘤进展。该技术在多个时间点检测循环系统中的肿瘤成分,跟踪整个肿瘤微环境在治疗过程中的动态变化。具体来说,与对其他治疗方法的反应相比,液体活检可能是监测免疫治疗反应更有吸引力的选择。由于循环中的大部分肿瘤成分会被免疫细胞攻击消除,而肿瘤来源的过量PD-L1成分可能在循环中存在更长时间。基于液体活检来估计肿瘤中PD-L1的表达,能帮助监测患者对免疫疗法的反应。抗体已成为液体活检中分离肿瘤成分最常用的捕获剂,这是由于其对特定癌症相关蛋白的高亲和力和选择性。然而,抗体的低热力学稳定性和高制造成本限制了它们的快速临床转化。此外,抗体由许多不同的官能团(例如氨基、羧基和巯基)组成,可能与任何生物物质发生非特异性相互作用。由于这些障碍,目前基于抗体的测定缺乏高临床实用性所需的灵敏度和特异性。为了克服这些问题,肽作为在小分子和蛋白质之间的分子中间体,正在考虑使用肽作为抗体的替代物。肽的一级结构和分子拓扑结构可以使用固相合成方法精确操作,这种模块化特性可以使肽按照需要的密度、方向和构象固定在底物上,最大限度地提高结合强度。在这项研究中,研究人员开发了一种基于PD-L1结合肽的多模式液体活检系统,有效检测了循环系统中不同大小的肿瘤成分,包括表达PD-L1的循环肿瘤细胞 (CTC) 和外泌体。为了有效靶向 PD-L1,研究人员整合了肽工程策略开发了增强PD-1结合强度和特异性的PD-1 β-发夹肽 (pPD-1) 。在研究中,检查了聚乙二醇间隔物、二级肽结构和肽序列修饰(例如去除生物学上多余的氨基酸残基)对PD-1捕获效率的影响。研究人员使用优化的pPD-1,捕获表达PD-L1的肿瘤细胞和肿瘤衍生的外泌体,其捕获效率分别比其PD-L1抗体 (aPD-L1) 高1.5 倍(p = 0.016)和 1.2 倍(p = 0.037)。该方法对患者基线样本中CTC检测效率提高了1.9 倍,外泌体增加了1.5 倍,表明与患者的治疗反应具有更强的相关性。此外,通过共同分析两种生物标志物(双峰CTC/外泌体分析)可以进一步提高该系统的临床准确性。这些数据表明,基于pPD-1的捕获是捕获表达PD-L1的CTC和外泌体的有前景的方法。参考文献:Bimodal liquid biopsy for cancer immunotherapy based on peptide engineering and nanoscale analysis. Biosens Bioelectron. 2022;213:114445.