脑胶质瘤(Glioma)是最常见的中枢神经系统恶性肿瘤,其中胶质母细胞瘤(GBM)恶性程度最高,约占一半以上。传统治疗方式对其效果不佳,术后易复发,生存期短,预后极差,复发率和病死率极高,其中位生存期约14个月,是青壮年首位肿瘤死因,被称为“新癌王”。肿瘤的恶性程度不仅取决于肿瘤细胞本身,还取决于肿瘤及其微环境之间的相互作用,其中肿瘤相关巨噬细胞在肿瘤微环境中所占比例最高。近年来大量研究证明,外泌体在胶质瘤发生发展及其免疫微环境的形成中发挥了重要作用。
近日,山东大学齐鲁医院李刚教授和薛皓研究员团队在国际权威杂志Oncogene发表了题为“Tumor-derived exosomes deliver the tumor suppressor miR-3591-3p to induce M2 macrophage polarization and promote glioma progression”(中科院一区,IF:9.867)的文章,再次证明了胶质瘤可以将抑癌的miRNAs通过外泌体排到细胞外,并且促进肿瘤微环境中免疫细胞的免疫抑制表型的转化,从而达到促进肿瘤恶性进展的双重作用。齐鲁医院神经外科李刚教授、薛皓副研究员为共同通讯作者,齐鲁医院神经外科博士研究生李明为论文第一作者,山东大学齐鲁医院是第一作者和通讯作者单位。
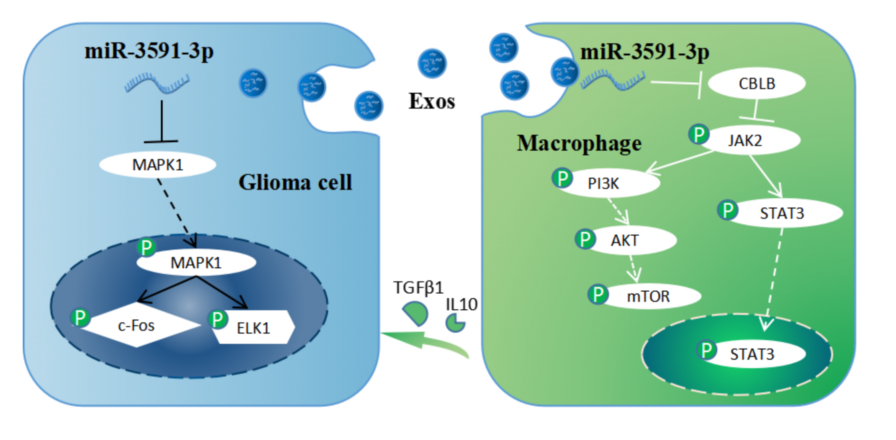
该团队在之前研究中对测序得到的miRNA进行分类(doi: 10.1038/s41419-022-04872-z.),筛选出外泌体型代表miRNA miR-3591-3p,证实miR-3591-3p可以通过靶向MAPK1蛋白进而影响MAPK信号通路来抑制胶质瘤的增殖能力并引起细胞凋亡;进一步研究发现胶质瘤细胞可通过外泌体将抑癌的miR-3591-3p排出肿瘤细胞来促进肿瘤的恶性进展;为了进一步研究抑癌的miR-3591-3p对免疫微环境的作用,研究人员在巨噬细胞中过表达miR-3591-3p,发现miR-3591-3p还可以促进TAMs的免疫抑制能力,从而进一步促进肿瘤的恶性进展,完全符合该团队之前的研究结论。
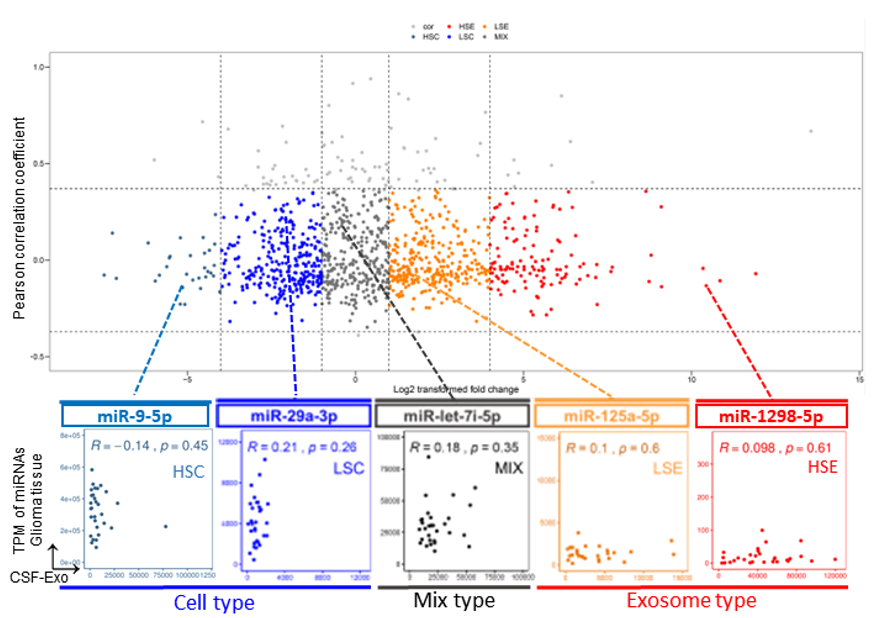
前期李刚教授、薛皓副研究员团队在国际权威杂志Cell Death & Disease 发表了题为“The dual role of glioma exosomal microRNAs: glioma eliminates tumor suppressor miR-1298-5p via exosomes to promote immunosuppressive effects of MDSCs”的文章,首次提出了脑胶质瘤外泌体miRNA促肿瘤的双重新机制假说。该研究通过对全级别全亚型脑胶质瘤患者肿瘤组织及其术前、术后和随访期的全病程脑脊液外泌体进行全转录组测序,在国家健康医疗大数据研究院和山大华链健康医疗大数据创新中心协助下,联合开发了国内外首个脑胶质瘤外泌体全病程全组学液体活检大数据库BrainLiquid&CEGA,并利用该数据库对脑胶质瘤患者肿瘤细胞和肿瘤外泌体中的各类分子标志物进行了全面系统研究,发现仅miRNA具有最稳定的表达特征和诊断能力;并将其按照分泌特征分为三大类5种亚型,即外泌体型(外泌体高选择型HSE和外泌体低选择型LSE)、细胞内型(细胞内高选择型HSC和细胞内低选择型LSC)和混合型(MIX)。经跨组学联合分析,发现外泌体高选择型HSE 的miRNAs多为抑癌miRNAs,而细胞内高选择型HSC中存在大量促癌miRNAs,揭示了肿瘤通过外泌体外排途径进行miRNA双向分选和促肿瘤细胞内、外微环境精细整体化调控的新机制。
本研究是对该假说的又一全新力证,上述结果表明胶质瘤可以一方面通过外排抑癌miRNA达到清除细胞内抑癌分子,促进肿瘤细胞进展的作用;另一方面通过将这些抑癌miRNA利用外泌体靶向运载至肿瘤微环境中的抑制性髓系免疫细胞(肿瘤相关巨噬细胞TAMs或髓系抑制细胞MDSCs),进而发挥促进肿瘤免疫微环境恶化,从而发挥双重促肿瘤的作用。该研究进一步验证了课题组之前提出的全新假设,为深入解析胶质瘤外泌体分选miRNAs的作用机制提供了新的理论依据。参考文献:Tumor-derived exosomes deliver the tumor suppressor miR-3591-3p to induce M2 macrophage polarization and promote glioma progression, Oncogene. 2022 Sep 9. doi: 10.1038/s41388-022-02457-w.