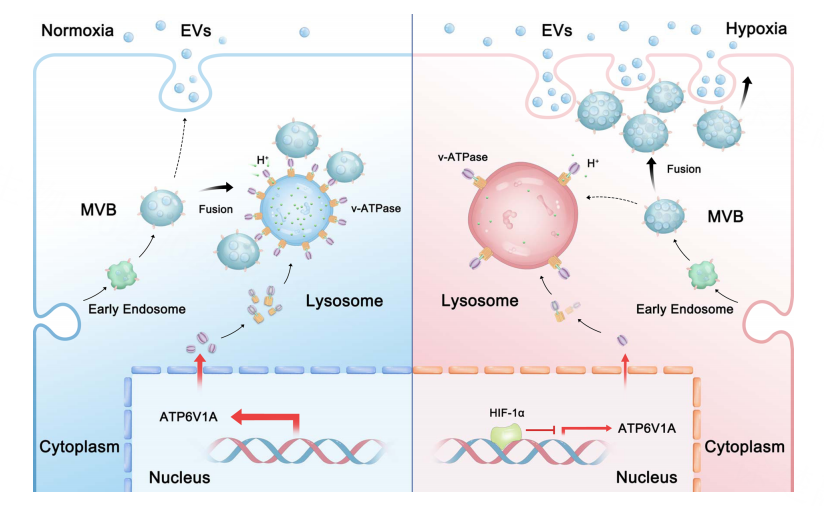
缺氧是肿瘤微环境的基本特征之一,而头颈部鳞状细胞癌(HNSCC)是实体肿瘤中缺氧最严重的类型之一。研究表明,在缺氧条件下,肿瘤细胞倾向于改变EVs的分泌数量和内容物,以调节肿瘤免疫抑制微环境的形成,然而缺氧影响EVs分泌的机制尚不明确。作为内体系统的主要细胞器之一,溶酶体的功能状态是调控细胞外囊泡(EVs)分泌的决定性开关。正常生理状态下,多泡体主要与溶酶体发生融合,导致EVs分泌减少。而缺氧条件是否能够通过引起溶酶体功能稳态失衡而影响外泌体的分泌仍然未知。
近日,上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科张建军研究员团队在Journal of Extracellular Vesicles期刊上发表了题为“ Hypoxia promotes EV secretion by impairing lysosomal homeostasis in HNSCC through negative regulation of ATP6V1A by HIF-1α ” 的研究论文(2023 Feb;12(2):e12310)。该研究首次阐明了一个低氧状态-溶酶体功能障碍- EVs释放轴,从理论层面扩展了EVs生物发生的机制框架。上海交通大学医学院附属第九人民医院李江教授和陈万涛教授为文章的共同通讯作者,博士研究生王晓宁为文章第一作者,硕士研究生吴若怡和翟培淞为文章的并列第一作者。
该研究首先通过纳米颗粒示踪分析(NTA)以及转录组测序等实验发现,与常氧状态相比,肿瘤细胞在缺氧条件下EVs的分泌增加约5-10倍,并且增加的EVs主要来自于内体生成途径(而非来自于出芽途径)。研究同时发现低氧显著改变了MVB(多泡体)的形态,其腔内囊泡(ILVs,EVs的前体)的数量增加,阻止了MVB与溶酶体的融合,导致内体系统来源的EVs分泌增加。并且,低氧可通过多种途径影响溶酶体功能,如促进溶酶体向细胞外周扩散、体积增大、pH值增加,破坏溶酶体内的酸性环境,致使溶酶体功能受到损坏。
进一步研究发现,在缺氧条件下V型ATP酶成员之一ATP6V1A表达受到显著抑制,缺氧通过降低ATP6V1A的表达破坏溶酶体的功能,促进EVs释放。低氧状态下HIF-1α的累积是导致ATP6V1A的表达下降的原因。HIF-1α通过靶向结合ATP6V1A启动子的TATA box片段抑制其转录活性。临床样本中也证实了HIF-1α与ATP6V1A呈负相关。该研究为以溶酶体-EVs为靶标的肿瘤免疫治疗提供了详实的证据支持。
综上所述,在缺氧条件下,肿瘤细胞中HIF-1α的积累可以抑制溶酶体的重要成分ATP6V1A的表达,从而破坏溶酶体的酸性稳态平衡,致使溶酶体功能障碍,进一步减少溶酶体与MVBs的融合,最终增加EV的释放。该研究不仅扩展了对低氧促进EV分泌的机制的理解,为ATP6V1A在肿瘤进展中的作用提供新的见解,更揭示了溶酶体稳态和EV分泌之间平衡的一种新的调节机制。
参考文献:
Hypoxia promotes EV secretion by impairing lysosomal homeostasis in HNSCC through negative regulation of ATP6V1A by HIF-1α. J Extracell Vesicles. 2023;12:e1231. DOI: 10.1002/jev2.12310.