外泌体是由所有活细胞(原核生物和真核生物)自然产生的小磷脂双层囊泡。外泌体由于其独特的尺寸,低免疫原性,以及携带各种抗癌药物时模拟脂质体的能力,已被证明作为癌症治疗的药物传递载体。尽管在过去的十年中,癌症外泌体相关研究的数量呈指数级增长,但基于外泌体的临床试验数量很少,原因是与大规模生产外泌体及其存储和稳定性和可扩展性方面面临挑战。来自美国俄克拉荷马大学的研究人员讨论了临床前和临床研究中基于外泌体的药物递送用于癌症治疗的最新进展,并总结了将更多基于外泌体的治疗方法转化为临床需要克服的挑战。相关综述内容以“Tumor-targeted exosomes for delivery of anticancer drugs.”为题于2月21日发表在国际期刊Cancer Letters杂志上。
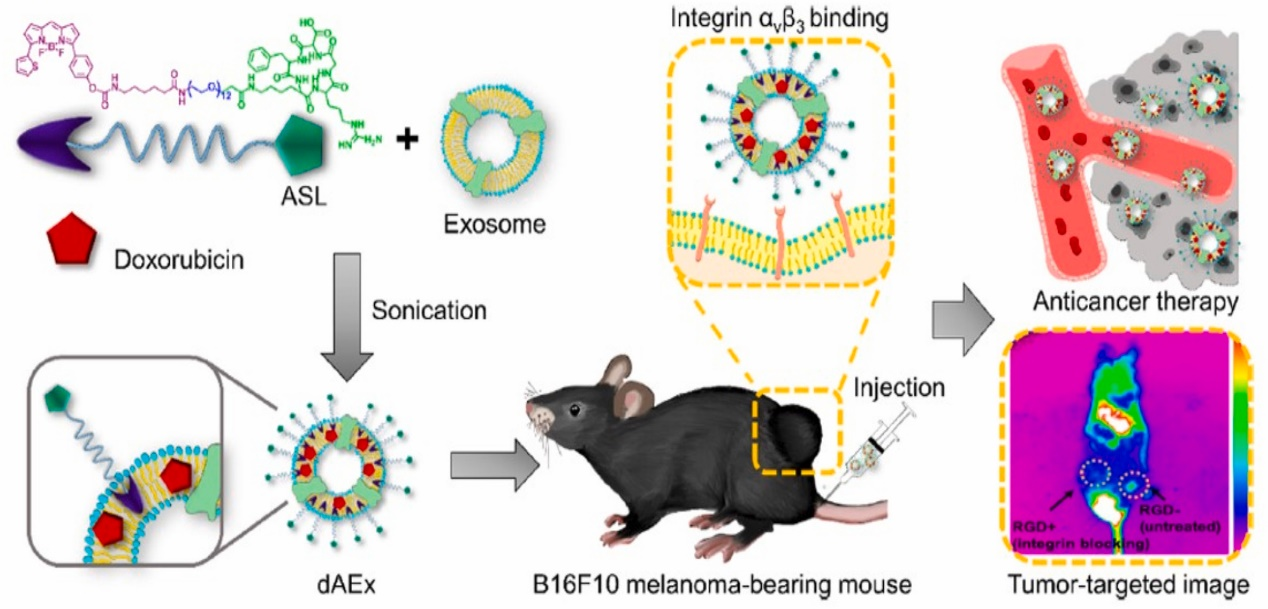
图:BODIPY- PEG- RGD环肽功能化的外泌体负载阿霉素用于黑素瘤治疗的示意图包括外泌体在内的细胞外囊泡(EV)是由包括微生物、植物、动物和人类在内的所有活细胞自然产生的。根据其大小、形态和生物发生方式,EV分为外泌体(30-120 nm)和微囊泡(>120 nm)。然而,国际细胞外囊泡学会(ISEV)根据细胞外囊泡研究的最小信息(MISEV)的建议,建议使用术语小型EV(sEV; < 200nm)和中大型EV(m/l-EV; >200 nm)代替外泌体和微囊泡。然而,根据惯例,许多实验室仍然习惯性继续使用“外泌体”一词,本文中提到的外泌体可互换为sEV。这篇综述的内容专注于外泌体及其作为癌症治疗药物载体的用途。外泌体由于体积小,能够穿越器官内的小细胞内空间,参与细胞间和细胞内生物分子的通讯和运输,并以自分泌和旁分泌的方式发挥功能。外泌体的细胞表面和腔内组成取决于产生外泌体的细胞类型和细胞的生物状态,从而反映细胞的起源。一般来说,外泌体是球形的,具有磷脂双分子层膜,内含各种细胞表面蛋白质,其腔内腔室装载着DNA、RNA、蛋白质、脂质、小的非编码(nc)和长链非编码(lnc)RNA。由于这些独特的特征,外泌体作为各种人类疾病(包括癌症)诊断和预测治疗结果的生物标志物来源已变得越来越重要。外泌体可以被分离、纯化,并使用各种方法从植物、微生物、天然化合物、细胞和体液(血液、尿液、母乳、唾液)和组织中进行表征。作者特别建议读者阅读用于外泌体分离和表征的各种方法和技术的相关综述文献,以及Srivastava等人的综述文章。外泌体除了在诊断方面具有吸引力外,由于其固有的小尺寸(< 200nm)的特性,也在药物传递领域引起了人们的兴趣。外泌体具有:在膜和腔内空间携带分子的能力、无免疫原性、它们的表面可适应各种化学和物理变化、以及进入细胞并转移其腔内内容物以介导信号传递的能力。鉴于这些优势,开发和测试外泌体作为治疗包括癌症在内的人类疾病的药物载体有了巨大的增长。在过去的十年中,大量临床前研究表明,外泌体介导的化疗药物、生物制剂和天然产物在体内和体外都具有强大的抗癌活性。虽然大量临床前研究的结果证明了基于外泌体的癌症治疗的巨大临床转化潜力,但基于外泌体的癌症临床试验数量很少,而且不成比例。原因是外泌体大规模生产的制造和可扩展性以及它们的存储和稳定性都存在挑战。克服这些挑战将有助于临床中基于外泌体的癌症治疗的案例增加。在篇综述里,研究人员讨论了临床前和临床研究中基于外泌体的药物递送用于癌症治疗的最新进展,并总结了将更多基于外泌体的治疗方法应用于临床需要克服的挑战。研究人员认为,癌症的发病机制主要涉及多个关键通路的失调,导致增殖和侵袭增加,最终导致转移。人们正在研究新型药物输送载体,以安全地输送药物和用于癌症的控制。在这方面,外泌体已被证明携带多种治疗分子来调节癌细胞中的多种途径。外泌体作为一种传递载体,与其他载体系统相比具有多种优势。生物细胞和组织样本的容易获得使它们具有生物相容性,从而减少了使用合成材料引起的免疫效应。其次,治疗部分被包裹在外泌体中,这提供了稳定性和提高生物利用度。此外,靶向配体可以附着在外泌体表面,以实现生物制剂向感兴趣位点的递送。另一方面,多种缺点阻止了获得基于外泌体的药物输送的最大潜力。虽然有许多使用外泌体进行治疗的临床前研究,但很少有研究达到临床试验。首先,缺乏优化的外泌体分离方案,外泌体纯化技术/试剂盒的实用性有限,这是一个巨大的挑战。此外,对于外泌体的首选分离方法和特征还没有明确的指导方针。此外,外泌体在大小上是异质的,生产和纯化用于药物输送的同质群体的技术很重要。其次,使用合适的癌细胞系和模拟疾病的动物模型也很重要。最后,外泌体介导的递送疗法在人类中的作用在很大程度上是未知的。关于人类中基于外泌体的系统的吸附和排泄机制的潜在问题还未有揭示。更多关于外泌体治疗的临床研究将集中在人体实验的安全性和毒理学特征上,这将弥补现有的差距,并为革命性的外泌体治疗癌症治疗铺平道路。参考文献:Tumor-targeted exosomes for delivery of anticancer drugs. Cancer Lett. 2023 Feb 21;558:216093.