间充质干细胞(Mesenchymal stem cells, MSC)具有独特的自我更新、多向分化、免疫调节和旁分泌的功能。MSC分泌的外泌体(Exosomes)被认为是细胞间通信的中心媒介,具有较高的归巢效率和较低的致瘤风险,因此在许多疾病治疗中显示出良好的治疗潜力。研究表明不同组织来源的MSC具有异质性,但是其分泌的外泌体是否存在功能差异尚待解析。结肠炎的发生和发展与肠道菌群密切相关,但是干细胞移植治疗与肠道菌群是否存在互作关系目前也并不清楚。
近日,昆明理工大学司维教授团队在Stem Cell Research & Therapy杂志发表题为“Perinatal tissue-derived exosomes ameliorate colitis in mice by regulating the Foxp3 + Treg cells and gut microbiota”的研究论文(2023 Mar 20;14(1):43)。
团队将人脐带和胎盘两种围产组织MSC来源的外泌体(hUC-Exos和hFP-Exos),分别通过尾静脉移植到DSS诱导的结肠炎小鼠模型中,发现hUC-Exos和hFP-Exos都能通过调节Th17和Foxp3+ Treg细胞的平衡来改善结肠炎小鼠的症状,并且hUC-Exos和hFP-Exos移植后能促使结肠炎小鼠的肠道菌群重新趋于与正常小鼠的组成。
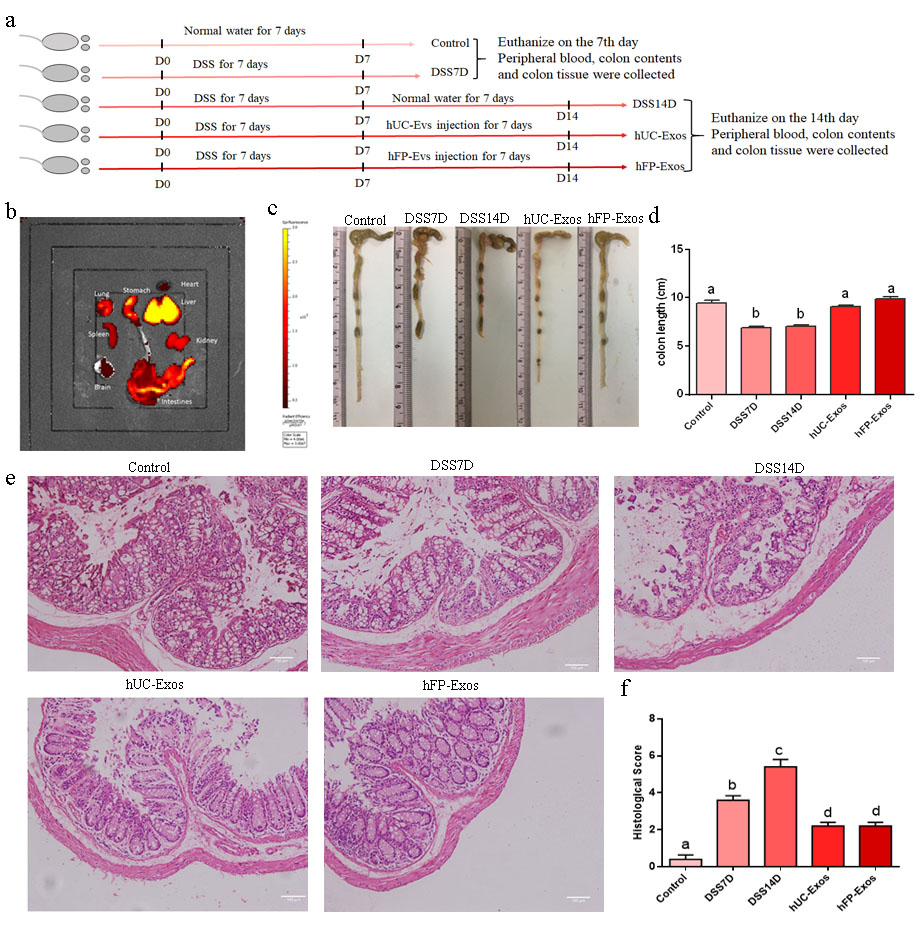
图1. hUC-Exos和hFP-Exos可以显著改善小鼠的结肠炎,包括结肠长度和结肠病理
给予小鼠灌喂7天的DSS后(DSS7D)后,发现小鼠外周血中IL-6、IL-17和IFN-γ大量产生,同时CD4+Foxp3+和CD8+Foxp3+细胞数量显著减少,这表明在DSS灌胃7天后Th17细胞被激活,Treg细胞被抑制。在DSS灌胃7天后继续正常饲养7天(DSS14D),发现DSS14D小鼠中CD4+Foxp3+和CD8+Foxp3+细胞的数量显著增加,但结肠长度没有恢复,结肠炎没有自愈,并且结肠病理进一步恶化,因此过度激活的Foxp3+ Treg细胞并不能扭转小鼠的结肠炎,反而进一步加重了小鼠的症状。相比之下,在hUC-Exos或hFP-Exos输注后7天,结肠炎小鼠中Treg和Th17细胞处于平衡,外泌体主要归巢至结肠炎小鼠的肝脏、胃、结肠和直肠部位。并且,hUC-Exos和hFP-Exos的输注还降低了促炎肠道细菌的丰度,如Verrucomirobia和Akkermansia muciniphila。因此hUC Exos和hFP Exos都能显著改善小鼠的结肠炎,并且表现出相同的治疗效果。
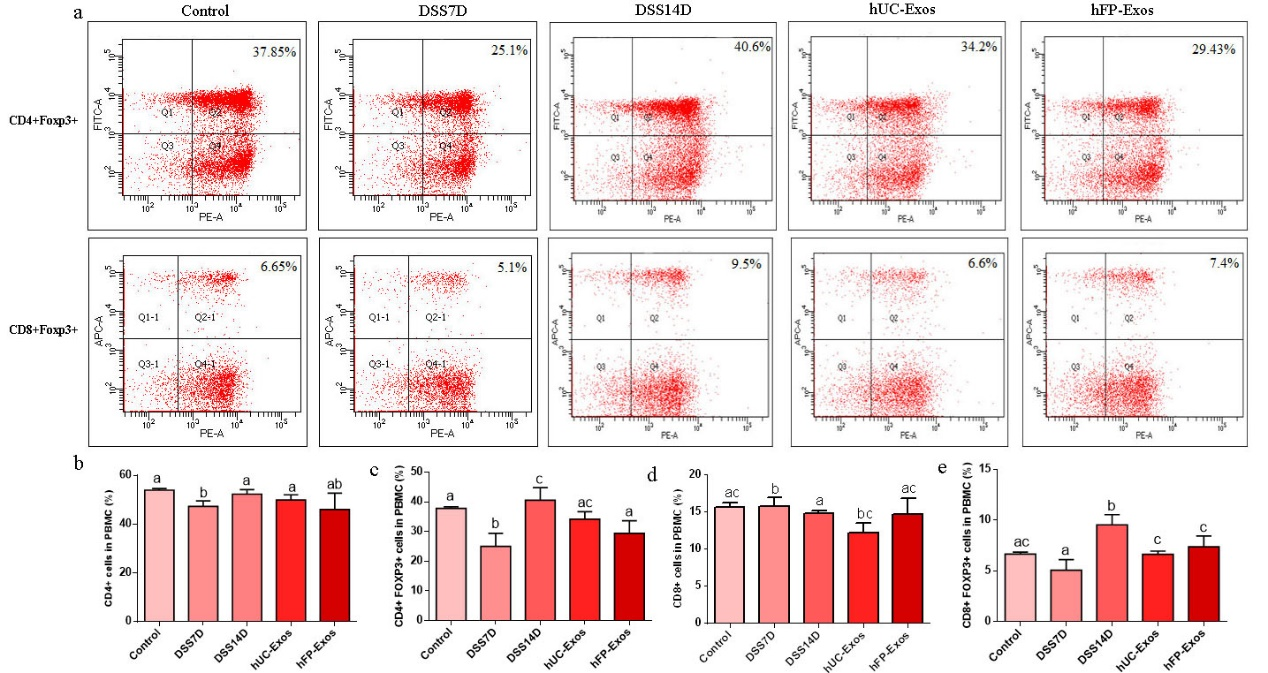 图2. hUC-Exos和hFP-Exos平衡Foxp3+ Treg和Th17细胞改善小鼠结肠炎
图2. hUC-Exos和hFP-Exos平衡Foxp3+ Treg和Th17细胞改善小鼠结肠炎
这项研究成果为结肠炎的治疗提供了策略,并且对疾病治疗中外泌体和肠道菌群的互作关系提供了新的启发。该研究工作受到国家科技部重点研发计划、国家自然科学基金等的资助。昆明理工大学司维教授为该研究论文的通讯作者,昆明理工大学博士生严亚萍,硕士研究生李开秀,云南省第一人民医院主任医师江江为共同第一作者。
参考文献:
Perinatal tissue-derived exosomes ameliorate colitis in mice by regulating the Foxp3 + Treg cells and gut microbiota. Stem Cell Res Ther, 2023, 20;14(1):43
外泌体资讯网 Stem Cell Res Ther |昆明理工大学司维:围产组织MSC来源外泌体通过调节 Treg细胞和肠道菌群缓解小鼠结肠炎