CD8+ T细胞对于清除病毒感染至关重要。在急性期,促炎条件增加循环磷脂酰丝氨酸(PS)阳性的细胞外囊泡(EV)的数量。这些EV尤其与CD8+ T细胞相互作用,然而尚不清楚它们是否能积极调节CD8+ T细胞的反应。来自德国路德维希-马克西米利安-慕尼黑大学的研究人员开发了一种方法,能够识别和表征体内自然发生的EV的细胞结合情况,发现激活的效应T细胞,而不是初始T细胞,在病毒感染期间广泛参与EV结合。并且,这种相互作用增加了淋巴细胞性脉络丛脑膜炎病毒感染小鼠中效应基因的表达和CD8+T细胞的增殖。相关内容以“Phosphatidylserine-positive extracellular vesicles boost effector CD8+ T cell responses during viral infection”为题于4月11日在线发表在国际学术期刊Proc Natl Acad Sci杂志上。
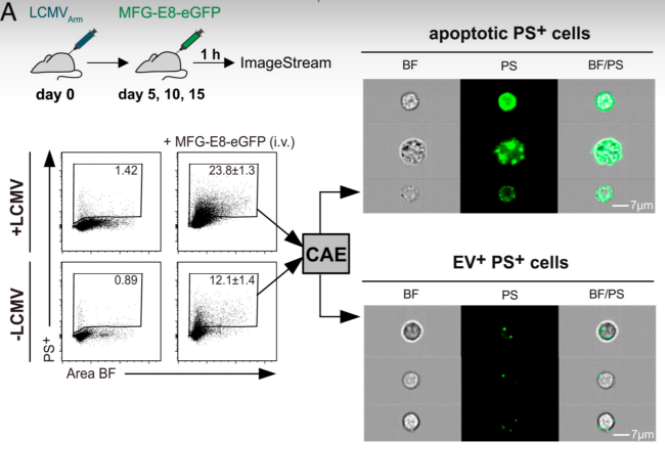
图:研究团队开发的MFG-E8-eGFP方法用于在体内检测PS+凋亡细胞和PS+ EV修饰细胞
T细胞具有抵抗病原体和肿瘤的保护作用。T细胞反应的启动和维持需要细胞间相互作用和分泌可溶性细胞因子传递的特定信号。其中,细胞外囊泡(EVs)构成了免疫反应中细胞间通信的机制。然而,EVs如何在体内影响T细胞的确切机制尚不清楚。
EV是由几乎所有类型的细胞释放的脂质双分子层膜封闭的球形结构。它们携带各种生物活性分子,包括蛋白质、脂质和核酸,能够在与受体细胞相互作用时发挥功能修饰和表型改变。由于EV在起源、大小和组成上具有高度异质性,研究人员已经对几种EV亚型进行了分类,主要包括外泌体和微囊泡。
早期的一些研究首先证明,B细胞系来源的外泌体携带有肽和主要组织相容性复合物(MHC) II,可在体外直接激活CD4+ T细胞。来自肿瘤肽脉冲的树突状细胞(DC)的EV可在体内引发强烈的CD8+ T细胞反应和肿瘤抑制,这进一步支持了EV参与抗原(Ag)呈递的观点。大量后续研究表明,抗原呈递细胞(APC)来源的EV,特别是由成熟DC释放的EV,可以作为抗原的来源,在体外和体内诱导T细胞增殖、记忆发育和抗肿瘤反应。DC衍生EV携带相关的MHC-I和-II复合物以及协同刺激分子,如CD86和CD54,用于与T细胞的生产性相互作用。然而,这种T细胞刺激的确切机制尚不清楚。
虽然一些报道显示EV单独可以在体外激活T细胞,但其他研究表明,EV刺激T细胞需要作为DCs的间接作用模式。因此,作为细胞独立的生物调节剂,游离EV在体内调节T细胞功能和分化的能力尚不清楚。
与凋亡细胞一样,EV也在其外膜层显示磷脂酰丝氨酸(PS)。基于该标记物,研究人员之前描述了一种敏感而可靠的方法来分析淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染小鼠和SARS -COV -2感染人类中的EV。在这些急性感染期间,研究人员发现,高频率的CD8+ T细胞活化与PS+ EV相关。
在这项研究中,研究人员开发了一种在体内分析细胞结合的PS+ EV及其靶细胞的方法。研究发现,在病毒感染期间EV+细胞的丰度增加,并且EV优先结合活化的CD8+ T细胞,而不是初始CD8+ T细胞。超分辨成像显示PS+ EV附着在T细胞表面CD8分子簇上。
此外,EV结合诱导抗原特异性TCR信号通路,并增加体内活化T细胞的转录因子(NFATc1)的核易位。EV修饰的CD8+ T细胞富集了与T细胞受体信号、早期效应因子分化和增殖相关的基因标记物,包括Ifng和Tnf等基因。因此,这些数据表明,PS+ EV在体内对活化的CD8+ T细胞提供抗原特异性的辅助作用,可以在急性感染期间通过直接与活化的抗原特异性CD8+ T细胞结合来促进效应基因的表达。
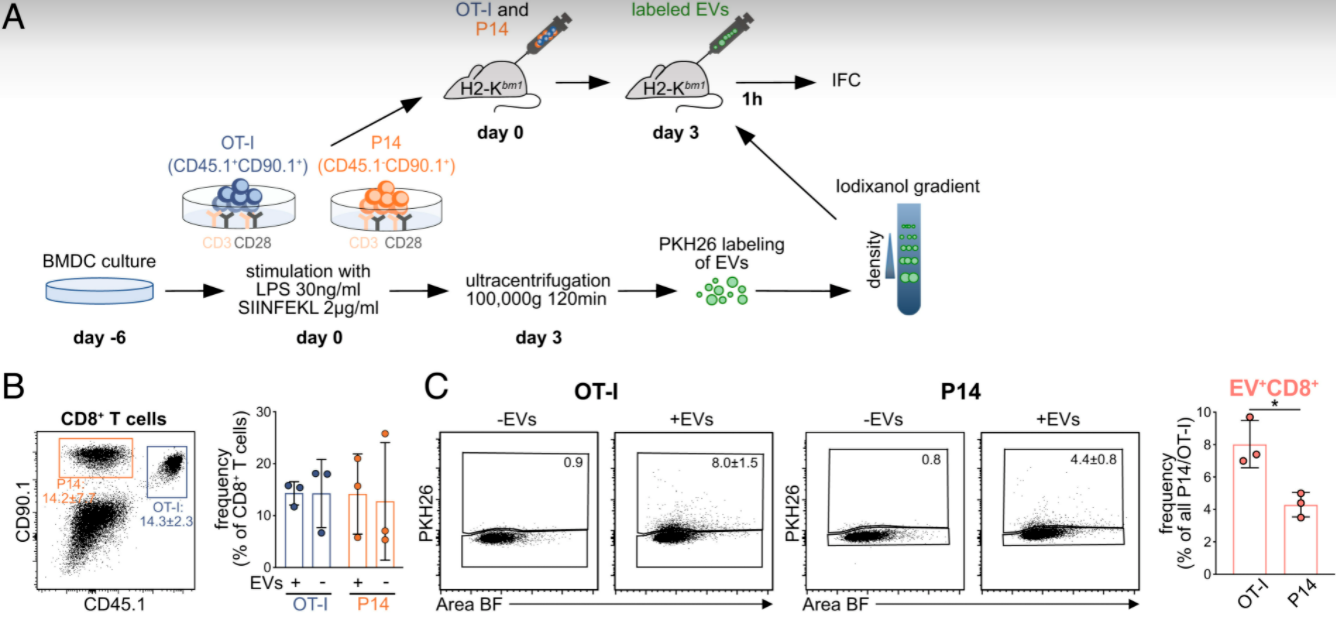
图:BMDC细胞衍生的EV对CD8+ T细胞的抗原依赖性的刺激实验
参考文献:Phosphatidylserine-positive extracellular vesicles boost effector CD8+ T cell responses during viral infection. Proc Natl Acad Sci U S A. 2023 Apr 18;120(16):e2210047120.