卵巢癌发病率居女性生殖系统恶性肿瘤第3位,死亡率居妇科恶性肿瘤之首。卵巢癌组织学类型多样,超过90%的卵巢恶性肿瘤为上皮性卵巢癌(epithelial ovarian cancer, EOC)。由于早期没有典型症状,缺乏高效的筛查手段,早期诊断困难,约75%的患者就诊时处于晚期,多数已存在肿瘤的广泛扩散和转移。化疗耐药是晚期卵巢癌患者预后不良的主要因素。肿瘤干细胞与化疗耐药密切相关。耐药性肿瘤细胞可通过分泌胞外囊泡(extracellular vesicles, EVs)携带蛋白质、核酸等传递肿瘤抗药性给受体细胞,使敏感性肿瘤细胞产生耐药。
近日,中国医学科学院肿瘤医院宋咏梅教授、孙力教授团队研究发现在耐药EOC细胞分泌EVs,通过胞间递送miR-6836将耐药性传递给敏感的EOC细胞。相关研究成果以“Extracellular vesicles carrying miR-6836 derived from resistant tumor cells transfer cisplatin resistance of epithelial ovarian cancer via DLG2-YAP1 signaling pathway”为题在International Journal of Biological Sciences杂志上发表(DOI:10.7150/ijbs.83264)。
该研究利用miRNA芯片和转录组测序筛选到在EOC化疗耐药患者组织中高表达、且与干性相关的miRNA:miR-6836。通过临床队列中收集的EOC患者组织及血液样本,验证了miR-6836在耐药EOC患者组织及EOC患者血中高表达。在体外通过肿瘤干细胞成球模型,明确miR-6836具有促进EOC细胞干性的能力(图1)。
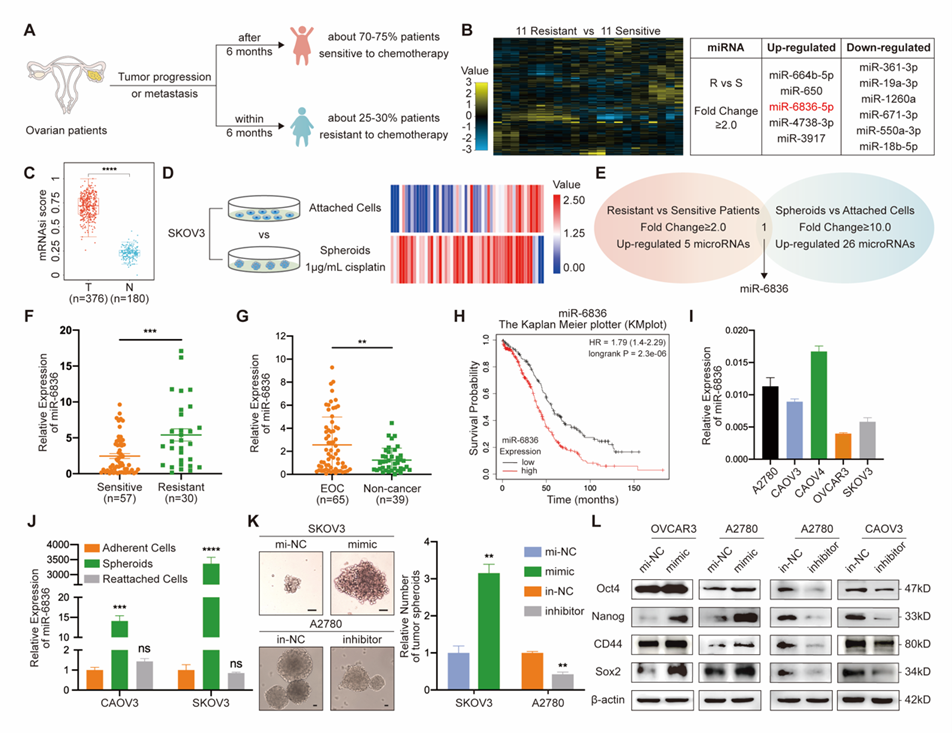 图1 miR-6836与CSC的干性及EOC患者的化疗耐药相关
图1 miR-6836与CSC的干性及EOC患者的化疗耐药相关
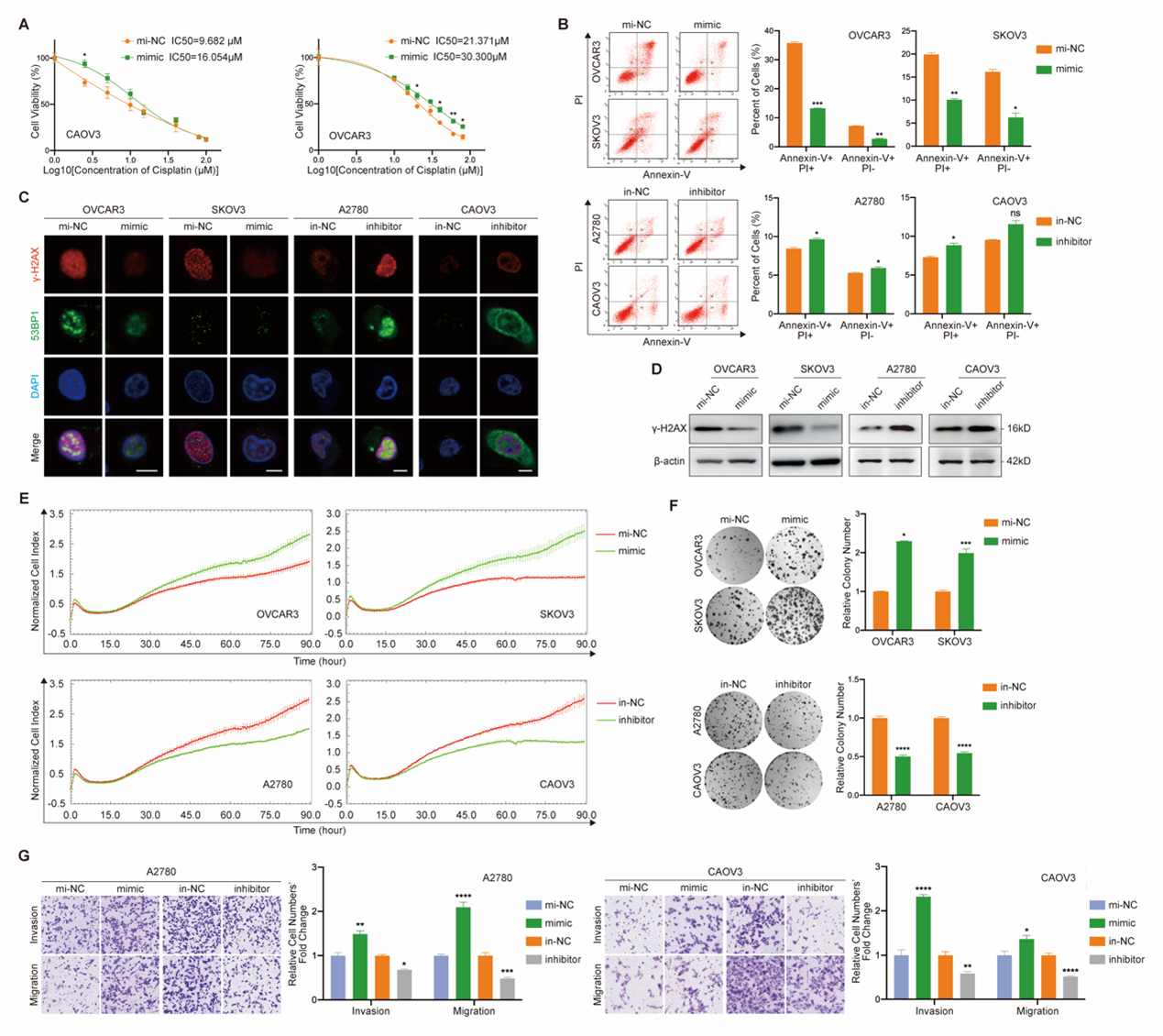
其次,在功能上,发现miR-6836在体外促进EOC细胞顺铂耐药、增殖、克隆形成以及侵袭迁移等恶性表型(图2);通过干性致瘤、皮下成瘤、腹腔注射等小鼠模型,证实miR-6836可在体内促进EOC细胞干性、增殖及腹腔转移(图3)。
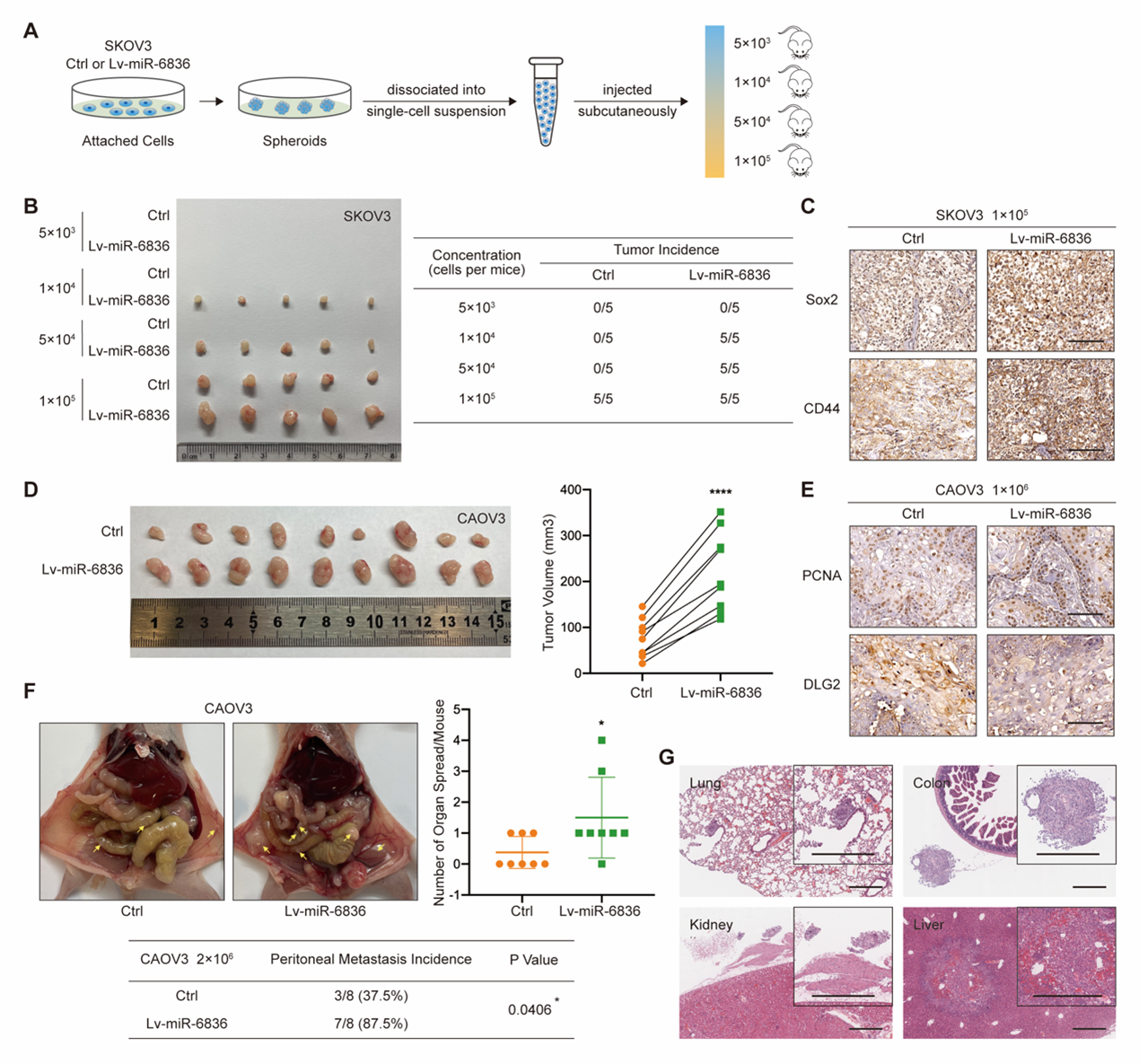 图3 miR-6836在体内诱导EOC细胞的干性、增殖与转移
图3 miR-6836在体内诱导EOC细胞的干性、增殖与转移
进一步通过转录组测序及Targetscan预测,推测DLG2为miR-6836关键靶基因,并通过RNA水平、蛋白水平检测及双荧光素酶报告实验证实。机制上,miR-6836直接靶向DLG2,通过促进Yap1核转位调控Hippo-Yap信号通路,而与Yap1互作的TEAD1是调控miR-6836表达的关键转录因子(图4)。
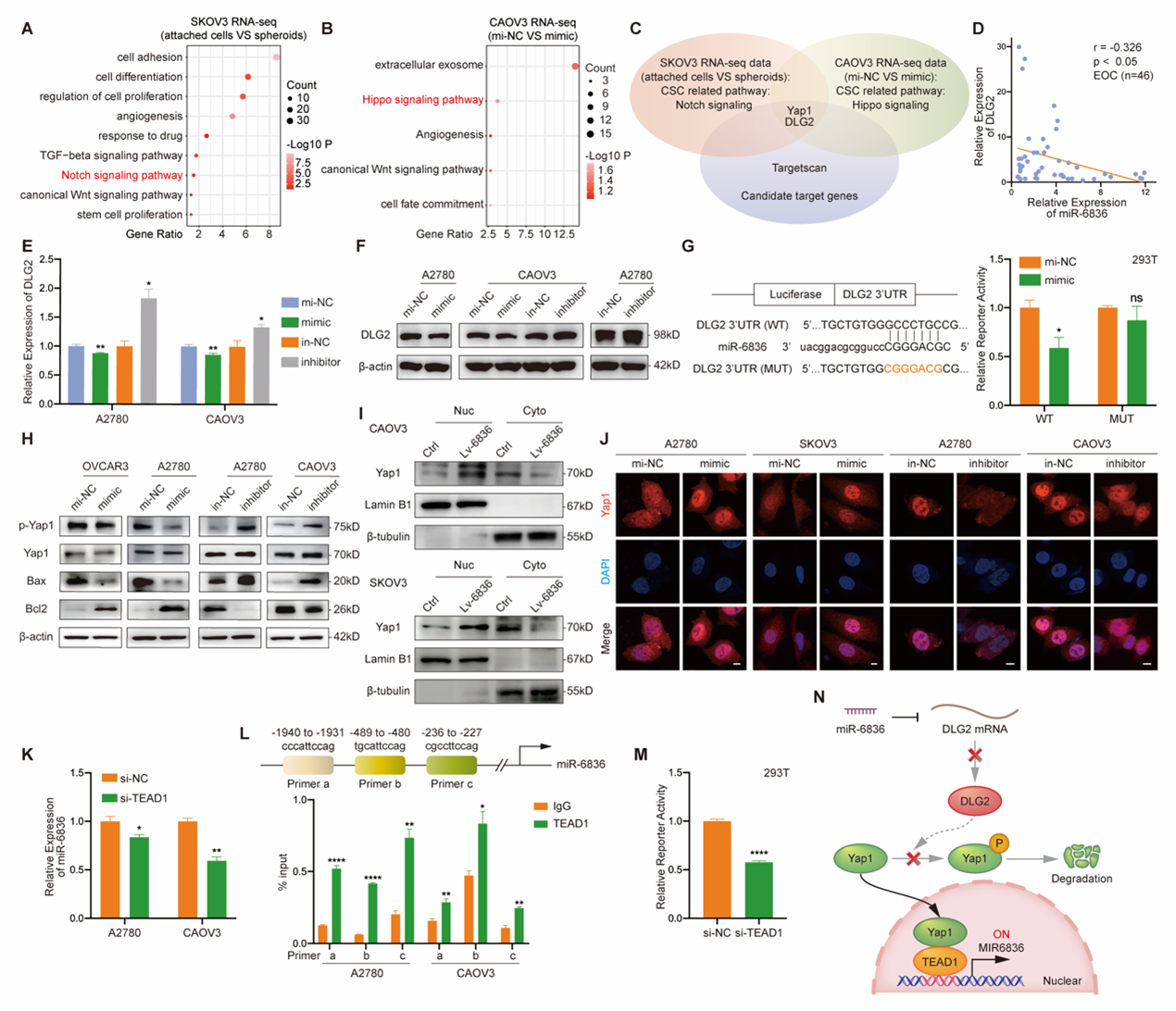 图4 miR-6836通过靶向DLG2调控Yap1亚细胞定位
图4 miR-6836通过靶向DLG2调控Yap1亚细胞定位
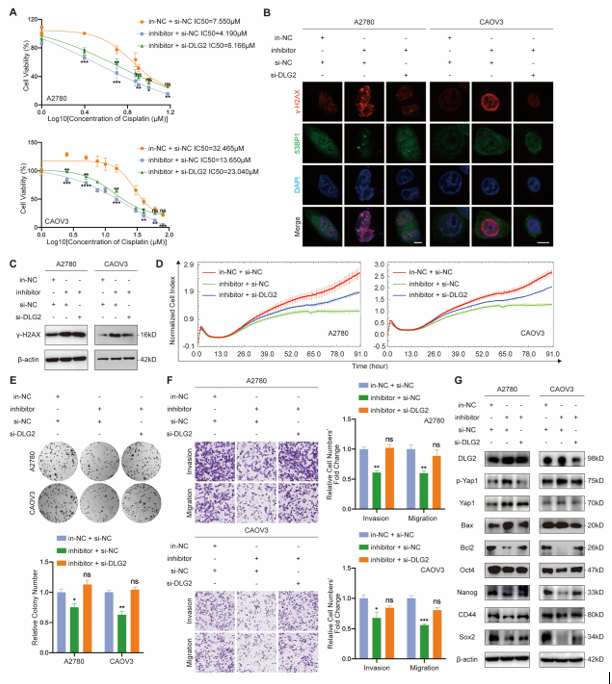
随后,为了验证miR-6836和DLG2之间的调控关系,通过在敲降miR-6836的基础上敲降其靶基因DLG2进行表型实验、及WB检测下游分子表达水平,证实下调DLG2可回复miR-6836抑制介导的恶性表型抑制,逆转miR-6836下调导致的促癌下游信号表达减少和抑瘤下游信号表达增加。证实miR-6836通过直接靶向DLG2促进EOC细胞的顺铂耐药(图5)。
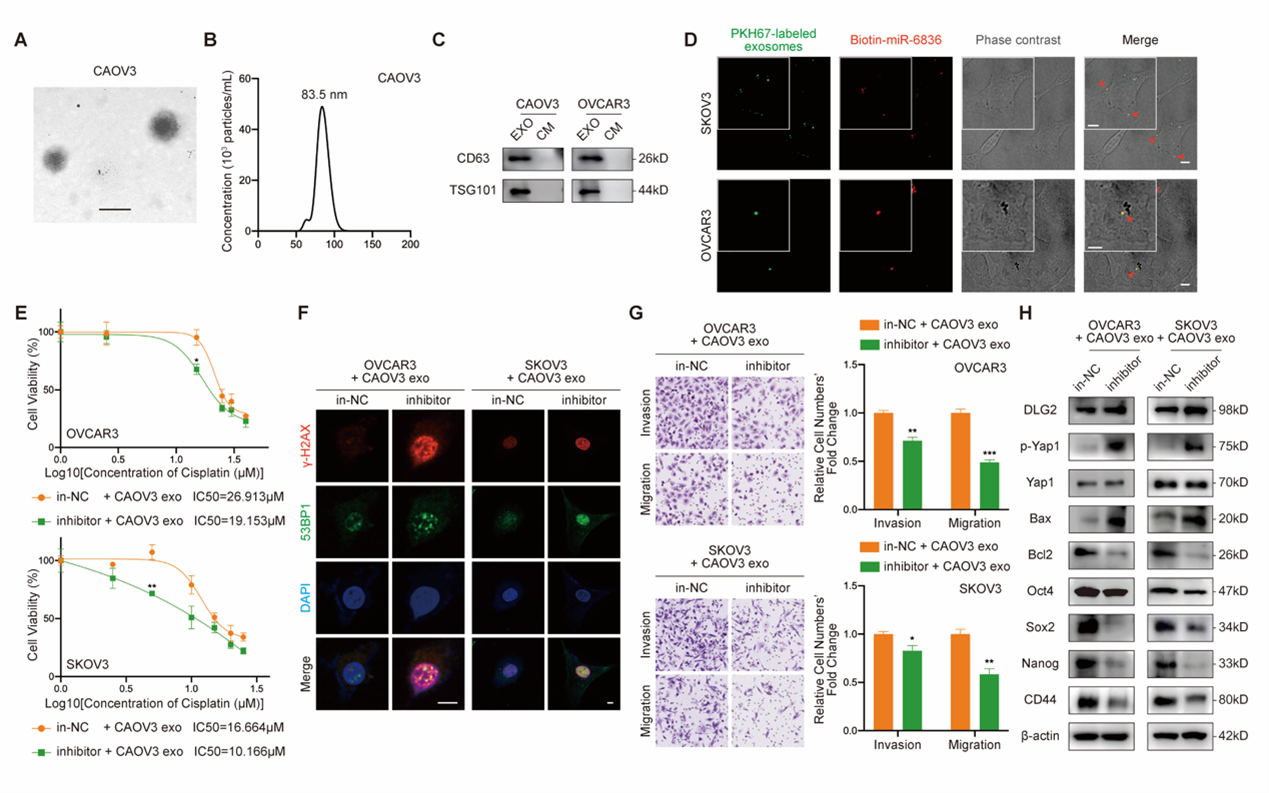
此外,利用超速离心法纯化EOC细胞分泌的EVs,外泌体摄取实验证明低表达miR-6836的EOC细胞可以摄取高表达EOC细胞分泌的外泌体miR-6836。外源添加EVs处理后,检测对EOC表型及下游信号通路的影响,结果表明外泌体miR-6836通过改变受体EOC细胞中的DLG2表达来传递顺铂耐药性(图6)。
最后,在动物模型中利用miR-6836拮抗剂与顺铂联用治疗卵巢癌,发现与miR-6836拮抗剂联用可显著提高顺铂的抗肿瘤效率(图7)。
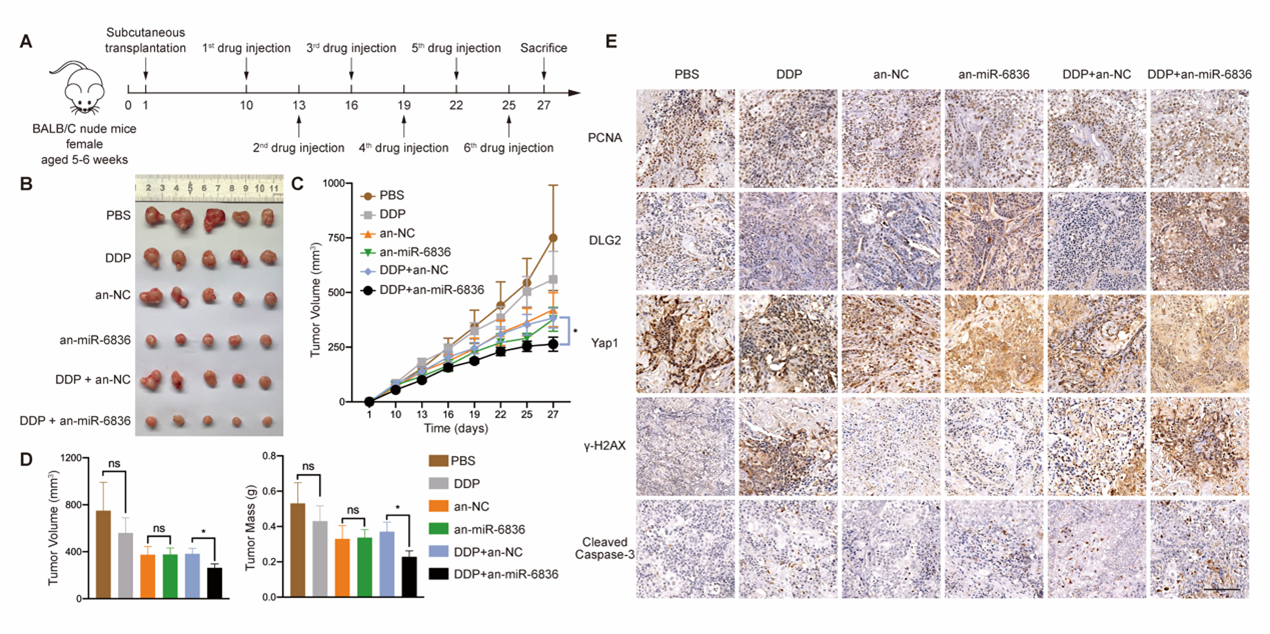 图7 miR-6836拮抗剂与顺铂联用治疗提高体内对EOC的顺铂敏感性
图7 miR-6836拮抗剂与顺铂联用治疗提高体内对EOC的顺铂敏感性
综上,该研究揭示了卵巢癌化疗耐药的新机制,并提示miR-6836可作为卵巢癌化疗耐药的潜在分子标志物及治疗靶点,为卵巢癌化疗耐药的诊断和治疗提供了新思路。
参考文献:
Extracellular vesicles carrying miR-6836 derived from resistant tumor cells transfer cisplatin resistance of epithelial ovarian cancer via DLG2-YAP1 signaling pathway. Int J Biol Sci. 2023 Jun 12;19(10):3099-3114. doi: 10.7150/ijbs.83264.
外泌体资讯网 Int J Biol Sci|医科院肿瘤医院宋咏梅/孙力团队:耐药型卵巢癌细胞通过外泌体传递miR-6836播散肿瘤耐药性