2015年,俞立教授团队在《Cell Research》发表论文,全球首次报告了一种全新的细胞器——迁移体(Migrasome)。迁移体是细胞迁移过程中产生出的膜性细胞器, 会随着细胞类型、状态的差异,包含不同丰富多样的内含物,介导包括胚胎发育、免疫反应、癌症转移等多种关键的生理过程,是体内天然信号递送系统。但如何启动迁移体形成尚不清楚。近日,清华大学俞立教授课题组在Nature Cell Biology发表论文,报道了鞘磷脂合成酶2 (SMS2) 在迁移细胞前缘组装形成聚焦点,从而决定迁移体的生长位点。
迁移体是新发现的一种细胞器,它从迁移细胞的收缩纤维(RFs)中生长出来。迁移体在各种生理过程中发挥重要作用,包括胚胎发育过程中的器官形态发生和血管生成。此外,研究表明,迁移体在细胞之间介导信使RNA的横向转移和通过一种被称为mitocytosis的过程驱逐受损线粒体。迁移体的生物发生机制尚不完全清楚。在迁移体生长之前,整合素焦点在RFs的分支点或末端形成,后来这些焦点就会生长成迁移体。因此,整合素焦点被定义为迁移体形成位点。迁移体的生长是由富含四跨膜蛋白的大型区域(TEMAs)的组装驱动的。在迁移体形成过程中,高度富含胆固醇的纳米级四跨膜蛋白富集微区(TEMs)在迁移体形成位点组装成TEMAs。这个过程导致了迁移体从迁移体形成位点的生长。鞘磷脂(SM)是细胞膜中最丰富的脂质之一。SM由SM合酶(SMSs)从神经酰胺合成。哺乳动物细胞中有两种SMSs,即高尔基定位的SMS1和高尔基和质膜定位的SMS2。神经酰胺在内质网上合成,然后通过神经酰胺转运蛋白CERT运输到高尔基。一旦神经酰胺到达质膜,SMS2将其转化为SM。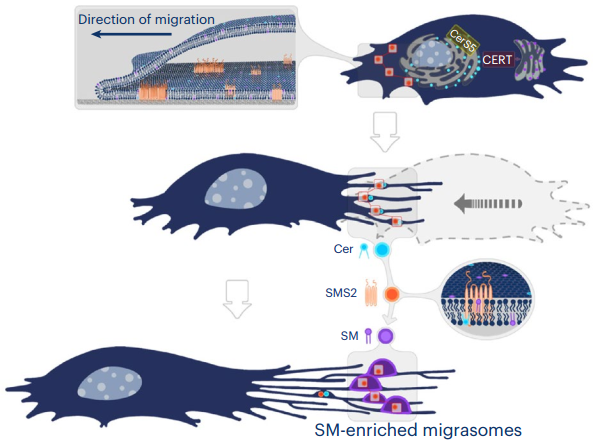
该研究发现,鞘磷脂在迁移体中富集,并确定鞘磷脂合成酶2(SMS2)是迁移体生物发生的必要蛋白质。SMS2组装成不动的聚焦点,粘附在前缘的基底膜上。当细胞迁移时,SMS2聚焦点“移动”出细胞并进入缩回纤维,在那里它们成为迁移体形成位点,并最终生长成迁移体。机制上,SMS2聚焦点通过将神经酰胺转化为鞘磷脂来启动迁移体形成,这对于迁移体形成至关重要。此外,合成长链神经酰胺所需的CerS5和将神经酰胺从内质网转运至高尔基体的CERT都是迁移体形成所必需的。该研究结果揭示了神经酰胺和鞘磷脂在迁移体形成中的重要作用,并表明SMS2形成基底膜表面连接结构,预先确定迁移体将生长的位置。这项研究发现阻止神经酰胺转化为SM会减少迁移体的形成。另一方面,已经确定生成神经酰胺可以以ESCRT独立的方式触发外泌体的形成。抑制或耗竭将SM转化为神经酰胺的中性SMS2会减少一部分外泌体的形成。脱落的迁移体在从细胞上脱落后作为细胞外囊泡释放。因此,操纵神经酰胺和SM之间的转化可能会对外泌体和脱落的迁移体的释放产生相反的影响。如果确实如此,细胞可能通过控制SM:神经酰胺比例来切换它们释放的细胞外囊泡类型,这可能具有深刻的病理生理学意义。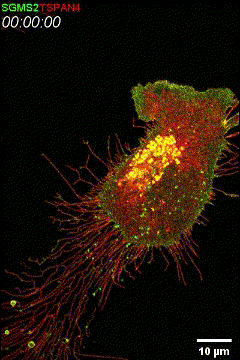
SGMS2(SMS2) foci启动迁移体形成。通过共聚焦显微镜以3分钟的间隔拍摄稳定表达SGMS2(SMS2)–GFP和TSPAN4–mCherry的L929细胞。https://www.exosomemed.com/9097.htmlhttps://www.exosomemed.com/11075.html基于全新生物学发现“迁移体生物学”,俞立教授领衔创立迈格松生物,专注于利用以迁移体为创新药物递送平台、迁移体疾病诊断及迁移体调控相关药物开发,以全新的视角解决重大未被满足医疗需求。近日,该公司完成了超亿元的天使轮股权融资。本轮天使+轮投资由中科金启航生物医药创业投资基金领投,其余投资方包括多个生物医药知名投资机构。据悉天使轮投资方包括:弘晖基金、高瓴创投、薄荷天使基金、清华控股。Liang H, Ma X, Zhang Y, Liu Y, Liu N, Zhang W, Chen J, Liu B, Du W, Liu X, Yu L. The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells. Nat Cell Biol. 2023 Jul 24. doi: 10.1038/s41556-023-01188-8. PMID: 37488437.外泌体资讯网 Nat Cell Biol:俞立团队揭示迁移体形成机制——鞘磷脂合成酶2(SMS2)