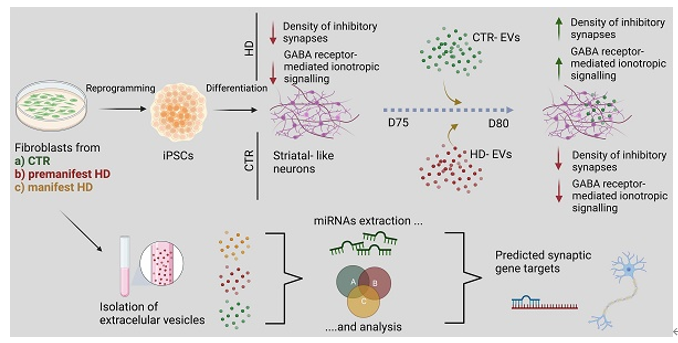
细胞外囊泡(EVs)携带了与各种生物过程相关的生物活性分子,包括miRNA。在亨廷顿病(HD)模型和人类样本中被发现参与突触调节的miRNA表达改变,而且利用EV货物来逆转突触病变作已经成为了可能。来自葡萄牙科英布拉大学的研究人员建立了人类HD模型并评估了EV对GABA能突触改变的影响,发现HD来源的神经元表现出突触标记物的抑制和GABA受体介导的离子性信号传导密度的降低。成纤维细胞分泌的EV治疗可以逆转GABA能突触传递的缺陷,并增加HD来源的多能干细胞分化而来的神经元培养物中的抑制性突触的密度。最后对纯化EV的miRNA进行分析,发现了一组具有预测突触靶点的差异表达miRNA。相关内容以“Extracellular vesicles improve GABAergic transmission in Huntington's disease iPSC-derived neurons”为题于6月26日发表在国际综合性医学学术期刊Theranostics杂志上。
亨廷顿舞蹈症(HD)是一种常染色体显性遗传病,与亨廷顿基因1外显子CAG三联体扩增有关。亨廷顿基因翻译的突变体亨廷顿蛋白(mutant huntingtin,mHTT)具有扩大的聚谷氨酰胺链的拉伸,导致构象改变、异常的蛋白质相互作用和聚集。该疾病的主要标志是纹状体中的中等棘状神经元(medium spiny neurons,MSN)的选择性丧失,其症状包括神经精神体征和认知缺陷,这些症状可发生在运动症状出现之前的15年以上。事实上,神经影像学研究表明,纹状体连通性在HD临床诊断前就已经发生了改变。
γ-氨基丁酸(GABA)能MSN是最常见的纹状体神经元,它们接受皮层的谷氨酸能投射,其丧失通常与皮层锥体神经元的丧失并存,主要发生在运动区和运动前区。GABA能信号的失调在HD发病中起着重要作用,尤其是GABAA受体介导的信号,在几种HD小鼠模型和人类患者的大脑中发生了改变。mHTT与不同的细胞器和蛋白质相互作用,特别是在突触,影响突触正常功能并最终导致变性:野生型(WT)和突变型亨廷顿蛋白(HTT)均与KCC2相互作用,KCC2是一种促进GABA能抑制信号传导的氯离子共转运蛋白,其表达减少导致HD小鼠模型海马过度兴奋。此外,mHTT通过干扰HTT相关蛋白1对KIF5(一种运动蛋白)的亲和力,破坏GABAA受体到突触的易位。mHTT和SorCS2蛋白之间的相互作用可调节MSN中NMDA受体亚基2A的运输,从而导致HD小鼠模型的运动缺陷。此外,介导脑源性神经营养因子(BDNF)信号的TrkB受体的树突运输被mHTT破坏,导致HD纹状体神经元中ERK通路活性降低。此外,PET成像分析显示,HD患者死后脑样本黑质和HD携带者纹状体中GABA含量和GABA能功能下降,HD小鼠模型外侧苍白球(external globus pallidus)中GABAA受体 α1和β2亚基mRNA和蛋白水平下降。最后,在HD小鼠模型中,存在于抑制性突触后的支架蛋白gephyrin也减少了,同时微小抑制性突触后电流(miniature inhibitory postsynaptic currents,mIPSC)频率和GABA能突触密度也减少了。因此,mHTT可能是GABA能突触活动的干扰者,恢复正常的GABA能功能可能有助于HD的治疗。
细胞外囊泡(EVs)是纳米级结构,作为细胞间信使,含有不同的生物活性物质,如脂质、蛋白质、DNA和miRNA。最近,与EV相关的miRNA在几种神经退行性疾病中的作用已经被探索,无论是作为生物标志物还是作为潜在病理过程的调节剂。miRNA是一种小的非编码RNA,对mRNA翻译具有调节作用,有助于维持多种神经元机制的平衡,包括突触的形成、成熟和功能。在HD小鼠模型的皮层和纹状体中,几种调节突触功能和成熟的miRNA的表达发生改变,导致其预测基因的水平发生变化。其中下调的miRNA之一是miR-132,参与甲基化CpG结合蛋白2(MeCP2)基因表达的调控,该基因被认为与mHTT异常相互作用并导致转录失调。MeCP2是突触可塑性和内稳态的重要调节因子,功能丧失或功能获得性突变会引发突触传递的相反变化。MiR-200a和miR-200c也被发现在HD中发生改变,它们的靶标包括neurexin 1,这对于维持纹状体回路中的突触功能很重要。重要的是,在HD大脑、脑脊液和血浆中,发现各种miRNA发生了改变,包括一些对神经元功能至关重要的miRNA。因此,由于失调的miRNA可能在HD发病机制中发挥重要作用,基于miRNA的治疗策略可能是有效的。
为了平衡这些病理学改变,一种有效的方法是使用EV进行治疗。虽然在HD模型中使用EV治疗主要帮助mHTT聚集减少和神经元存活增加,但关于其他病理条件的研究报道了EV给药对突触传递的影响。在这项研究中,研究团队将人诱导多能干细胞分化为电生理活跃的纹状体样GABA能神经元。根据课题组先前的疾病分期特征,研究人员利用成纤维细胞分泌的EVs去处理纹状体样神经元。用对照组(CTR)成纤维细胞分泌的EV治疗HD患者来源的纹状样神经元后,研究人员观察到神经元GABA能信号的改善。相反,由HD来源的成纤维细胞分泌的EV在CTR神经元上产生相反的结果,这表明EV在细胞毒性效应的传播和影响神经元功能方面发挥了作用。此外,研究人员在HD- EV和CTR - EV中观察到不同的miRNA谱,证明EV -miRNA可能作为突触相关蛋白的调节因子并参与HD病理进展。
参考文献:Extracellular vesicles improve GABAergic transmission in Huntington's disease iPSC-derived neurons. Theranostics. 2023 Jun 26;13(11):3707-3724.