在心肌细胞收缩过程中,线粒体质量控制对心肌稳态至关重要,因为线粒体负责产生维持收缩所需的大部分能量。功能失调的线粒体通常通过聚集在溶酶体上的细胞内降解途径降解。近日,来自美国加州大学圣地亚哥分校的研究人员描述了一种细胞中线粒体清除的不同机制,当Rab7蛋白缺失或溶酶体功能受损时,大的细胞外囊泡可以完成受损线粒体的胞外分泌。因此,当溶酶体功能受损时,该机制可能作为一种替代的细胞质量控制途径,以保护细胞免受有害货物的积累的影响。相关内容以“Mitochondria are secreted in extracellular vesicles when lysosomal function is impaired” 为题于8月18日在线发表在Nature子刊、国际知名综合性学术期刊Nature Communications杂志上。
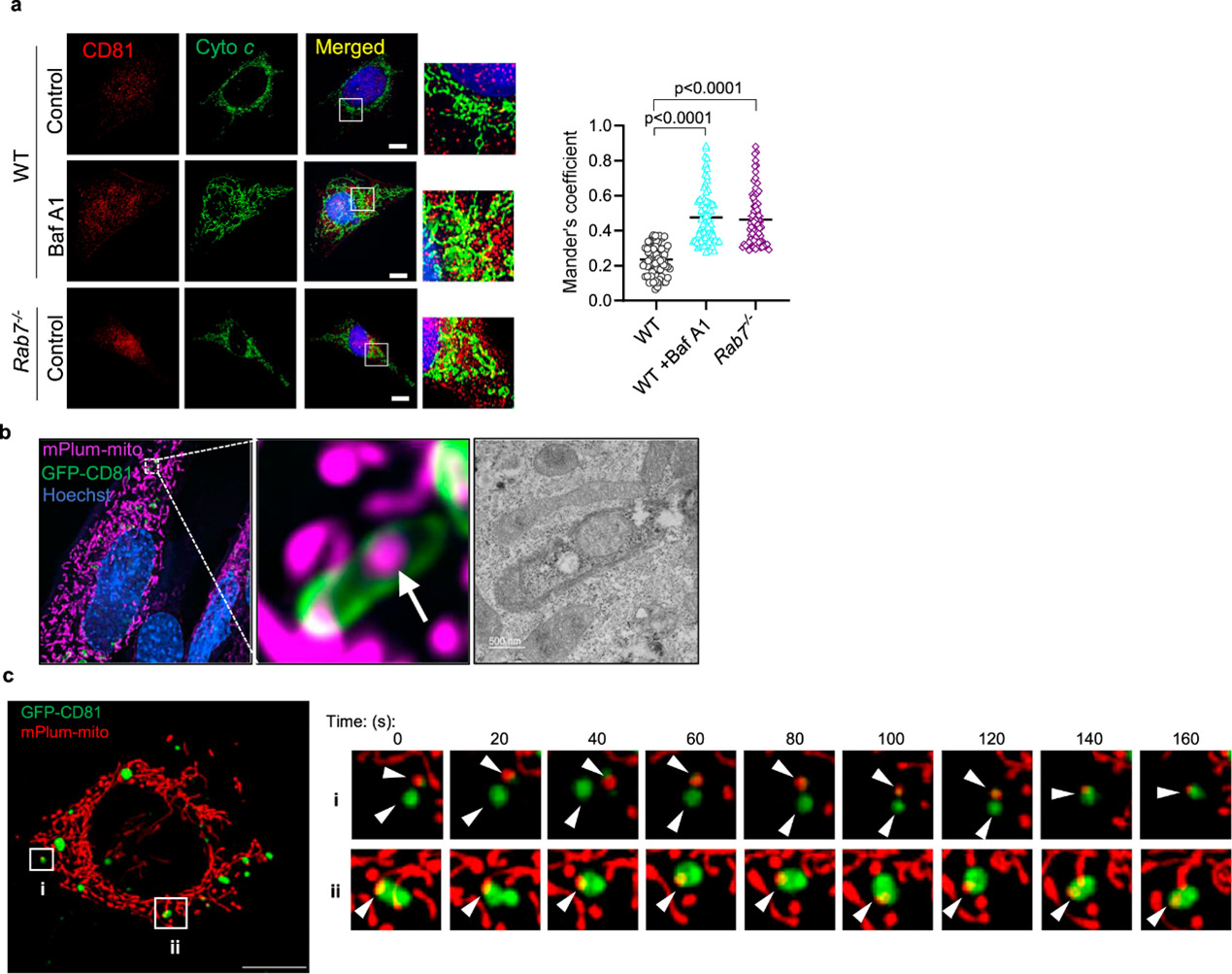
图:线粒体在CD81阳性的大囊泡中积累
心肌细胞收缩需要高水平的ATP,而ATP主要由线粒体的氧化磷酸化提供。然而,功能失调的线粒体会产生过多的活性氧(ROS),导致细胞成分或者细胞器损伤,这些细胞器也可以直接激活细胞死亡途径。因此,有效去除异常线粒体对于维持细胞稳态和心脏功能至关重要。为了防止不必要的细胞死亡,细胞进化出各种机制来修复或移除功能失调的线粒体。这些质量控制途径在终末分化的心肌细胞中尤为重要,因为心肌细胞不能通过细胞分裂减少损伤细胞的比例,也很那完成细胞再生。自噬是清除心脏中功能失调线粒体的主要途径,路径包括自噬体将线粒体分离,然后将货物运送到溶酶体。线粒体也可以被早期核内体吞噬,或直接被溶酶体吸收。虽然细胞中存在多种线粒体降解机制,但这些途径都汇聚在溶酶体上,溶酶体最终负责蛋白质聚集体和细胞器的最终分解。当溶酶体功能受损或超载时,是否存在其他线粒体质量控制途径目前尚不清楚。
众所周知,细胞会向细胞外空间释放直径在0.05-1 μm之间的不同来源的囊泡。细胞外囊泡(EVs)是在晚期胞内体(late endosomes,LE)/多泡体(MVB)与质膜融合或通过质膜出芽后释放的。研究报道,这些囊泡通过向受体细胞传递核酸、蛋白质和脂质参与细胞通讯。在各种疾病或压力下,EV的释放会增加。例如,在心肌梗死期间,从心脏释放的EV增加。在啮齿类动物和人类的运动过程中,骨骼肌分泌的EV也增加了。据报道,EV可以促进受伤骨骼肌组织的再生。然而,也有新的证据表明,EV可能是细胞质量控制的另一种途径。在阿尔茨海默病和帕金森病患者中分别检测到含有β-淀粉样蛋白和α-突触核蛋白的EV。据报道,细胞还会释放出大的(3.5-4 μm)亚细胞结构,称为exophers,比传统的EV大得多。有趣的是,一些研究已经确定线粒体蛋白是EV的货物,但它们的功能和释放机制仍然知之甚少。
含有EV的内体囊泡的形成和运输受Rab GTPases的调控。Rab7存在于LE/MVB上,是LE/MVB与溶酶体融合所必需的。Rab7还参与调节自噬体-溶酶体融合,表明这两种内部降解途径之间存在关联。Rab7是否在调节LE/MVB与质膜融合并将EV释放到胞外空间中发挥作用尚不清楚。
达农(Danon)病是一种罕见的X染色体显性遗传病,主要表现为心肌病症状。Danon病由溶酶体相关膜蛋白2(LAMP2)基因的功能缺失突变引起的,导致自噬降解受损和心肌病的发展。有趣的是,患者在儿童早期通常没有症状,这表明其他机制补偿了有缺陷的自噬-溶酶体降解途径。
在这项研究里,研究人员发现了当溶酶体功能受损时,消除线粒体的另一种机制。研究发现,溶酶体抑制导致大EV中线粒体成分的分泌增加。EV是在多泡体中产生的,它们的释放不依赖于自噬。细胞或成年小鼠心脏中小GTPase Rab7的缺失导致含有泛素化产物的EV分泌增加,包括完整的线粒体。分泌的EV被巨噬细胞捕获而不激活炎症反应。老年小鼠或Danon病患者的心脏中含有线粒体的分泌EV水平升高,表明在心脏病理生理过程中囊泡释放被激活。总的来说,这些发现表明,当溶酶体降解被抑制时,线粒体可以在大EV中通过内体途径被消除。
这项研究描述了当溶酶体介导的降解受损时,细胞和心脏中线粒体质量控制的独特过程。由于线粒体是细菌起源的,被包裹在EV中的线粒体分泌到胞外,可以避免潜在有害的炎症反应的激活。目前,人们对开发激活心脏自噬的治疗方法非常感兴趣。然而,增加自噬体形成到超过溶酶体降解能力的水平可能导致细胞分泌的货物增加。虽然EV分泌对周围细胞的影响似乎很小,但未来的研究还需要阐明过度分泌是否会影响心脏中其他细胞类型的功能。
参考文献:Mitochondria are secreted in extracellular vesicles when lysosomal function is impaired. Nat Commun. 2023 Aug 18;14(1):5031.