长期以来,骨髓细胞表达的ApoE被认为是免疫调节的一个来源。除了有助于血浆中的apoE库有利于肝脏介导的残余脂蛋白清除之外,骨髓细胞表达的apoE还能够发挥细胞内在和细胞外在特性,共同塑造高脂血症中白细胞的免疫库和炎症状态。虽然骨髓细胞表达载脂蛋白 E (apoE) 被认为可以控制炎症,但这种益处是否可以通过细胞外囊泡传递尚不清楚。近日JEV杂志上的一篇研究的结果揭示了巨噬细胞apoE表达的另一个免疫调节特性。巨噬细胞的apoE表达对于巨噬细胞通过外泌体向受体细胞传递免疫代谢信号的能力至关重要。
载脂蛋白 (Apo) E 是一种 34 kDa 的蛋白质,包含三种常见的亚型,最初因其在控制血浆中富含胆固醇的脂蛋白水平方面的核心作用而被发现,从而预防动脉粥样硬化和心血管疾病。此后不久,apoE 因其发挥多效性以维持组织稳态的能力而受到越来越多的认可。其中包括调节免疫细胞活动和炎症的能力。虽然 apoE 的表达仅限于骨髓细胞,但 apoE 通过仍不完全了解的旁分泌机制对多种类型的白细胞发挥控制作用。
巨噬细胞是哺乳动物中 apoE 表达的第二重要细胞来源,被认为贡献血浆中高达 10% 的 apoE。 虽然 apoE 表达的这种来源已被证明可以通过增强血浆脂蛋白清除率来预防动脉粥样硬化,但许多其他途径也已经被发现。 巨噬细胞apoE表达改善细胞胆固醇流出和凋亡细胞的吞噬摄取,同时还减少细胞表面炎症细胞因子和共刺激分子的表达,共同限制病变炎症。 研究还表明,骨髓和脾脏的造血干细胞和祖细胞 (HSPC) 中的 apoE 表达通过限制质膜中富含胆固醇的脂筏中的受体复合物来限制骨髓细胞生成,从而减少增殖信号传导。 此外,最近发现巨噬细胞中的 apoE 表达可以调节 microRNA 控制的 NF-κB 信号传导,从而限制高脂血症小鼠的炎症细胞因子的产生和动脉粥样硬化。
尽管巨噬细胞产生的细胞因子被认为可以差异调节炎症及其在高脂血症和动脉粥样硬化中的解决,但细胞外囊泡(EV)最近已成为细胞间信号传导的新来源。 事实上,研究表明,巨噬细胞产生的 EV 可以差异化地控制受体细胞的炎症特性,包括在癌症、动脉粥样硬化和肥胖模型中。虽然巨噬细胞 apoE 表达被认为在调节细胞炎症和组织修复特性中发挥核心作用,但它是否也控制 EV 的产生和细胞信号传导特性尚不清楚。该研究试图在高脂血症的背景下解决这个问题。
该研究结果表明,虽然 apoE 表达的丧失不会改变培养的巨噬细胞分泌 EV 的速率或大小,但它会严重影响其细胞信号传导特性。野生型巨噬细胞(WT-BMDM-EV)产生的EV通过驱动受体骨髓细胞中的脂肪酸氧化(FAO)和氧化磷酸化(OxPHOS)来传达抗炎特性。相比之下,Apoe-/-巨噬细胞(EKO-BMDM-EV)产生的EV通过增加糖酵解和氧化应激来传达炎症信号。与WT-BMDM-EV输注至高脂血症小鼠后可解决全身炎症不同,EKO-BMDM-EV 的输注可增加造血作用并激活骨髓细胞和 T 淋巴细胞。 总之,该研究结果揭示了巨噬细胞 apoE 表达可以控制免疫并限制高脂血症炎症的新特性。
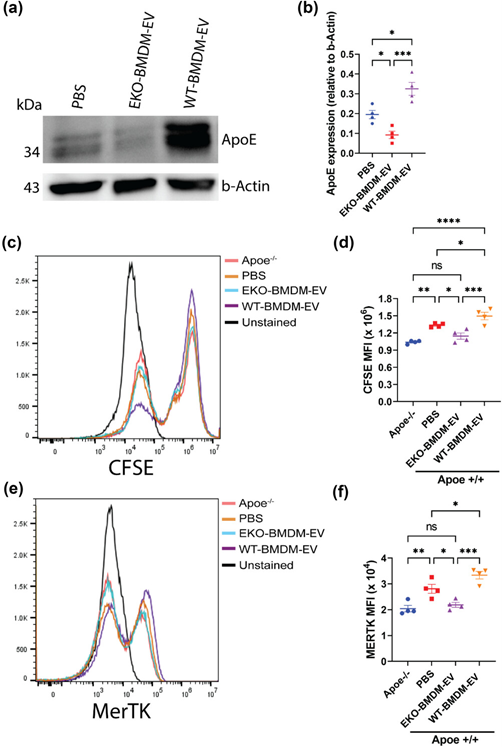
巨噬细胞EV调节细胞apoE蛋白水平和受体巨噬细胞的吞噬能力
通过对野生型(WT-BMDM-EV)和ApoE缺陷型(EKO-BMDM-EV)小鼠骨髓巨噬细胞产生的细胞外囊泡的研究,发现了apoE表达在调节其细胞信号传导特性中的关键作用。WT-BMDM-EV通过增加apoE和miR-146a-5p的细胞水平,从而减少NF-κB信号传导,向受体骨髓细胞传达抗炎特性。他们还下调了miR-142a-3p的细胞水平,导致其目标肉毒碱棕榈酰转移酶1A(CPT1A)的水平增加,从而改善了受体细胞中的脂肪酸氧化(FAO)和氧化磷酸化(OxPHOS)。这种有利的代谢极化增强了细胞表面MerTK水平和凋亡细胞的吞噬摄取。相比之下,EKO-BMDM-EV通过降低apoE和miR-146a-5p的细胞水平发挥相反的作用,从而增加NF-κB驱动的GLUT1介导的葡萄糖摄取、有氧糖酵解和氧化应激。此外,EKO-BMDM-EV增加了细胞miR-142a-3p水平,从而降低了CPT1A水平并损害了受体骨髓细胞中的FAO和OxPHOS。当与初始CD4+T淋巴细胞一起培养时,EKO-BMDM-EV驱动它们的激活和增殖,并促进它们向Th1表型的转变。将WT-BMDM-EV输注到高脂血症小鼠中可以解决炎症,而输注EKO-BMDM-EV则可以增加造血作用并驱动骨髓细胞和T淋巴细胞的炎症反应。巨噬细胞胞外囊泡的ApoE依赖性免疫代谢信号依赖于miR-146a-5p和miR-142a-3p控制的转录轴,可以通过将miR-146a模拟物和miR-142a拮抗剂注入高脂血症apoE缺陷小鼠中来复制。总之,该研究结果揭示了巨噬细胞中apoE表达的新特性,可调节其分泌的细胞外囊泡的免疫代谢调节特性。
参考文献:
Phu TA, Ng M, Vu NK, Gao AS, Raffai RL. ApoE expression in macrophages communicates immunometabolic signaling that controls hyperlipidemia-driven hematopoiesis & inflammation via extracellular vesicles. J Extracell Vesicles. 2023 Aug;12(8):e12345. doi: 10.1002/jev2.12345. PMID: 37593979; PMCID: PMC10436255.





