细胞外小囊泡(EVs)自1956年以来在多项研究中被观察到,其表面覆盖有磷脂膜,包含供体细胞的胞质。根据获取分离方式差异,EVs可以被分为细胞培养衍生的EVs、体液衍生的EVs和组织衍生的EVs(Ti-EVs)。以往的EVs研究主要集中在前两种类型,但针对Ti-EVs在肿瘤领域的研究仍具有一定的局限性。2023年10月18日,来自四川大学华西医院甲状腺外科的雷建勇团队,在国际期刊Cancer and Metastasis Review (IF: 9.2) 上发表题为“Tissue-derived extracellular vesicles in cancer progression: mechanisms, roles, and potential applications”的综述(doi: 10.1007/s10555-023-10147-6),系统阐明了Ti-EVs在肿瘤组织环境影响下行使细胞间通讯功能的机制,以及它们在肿瘤进展中的关键作用。此外,文章总结了Ti-EVs在肿瘤的诊断和治疗中的潜在作用,旨在为未来的Ti-EVs相关研究提供全面的参考。四川大学华西医院甲状腺外科的雷建勇副教授为论文的通讯作者,博士研究生叶子炀为文章的第一作者。

Ti-EVs直接来源于组织,它们在细胞间基质中迁移,并在局部或远处发挥作用。与细胞和体液来源的EVs相比,Ti-EVs具有更接近真实生理状态的三维结构,这确保了Ti-EVs可以更准确地反映组织环境的变化,使其在研究细胞外囊泡与肿瘤等疾病进展的关系具有优势。最近的研究提供的证据表明Ti-EVs在肿瘤微环境中的生成和移动受到其他细胞和细胞外基质的特异性调控,这些囊泡与肿瘤组织存在复杂的相互作用关系(如图一)。肿瘤组织中有相当一部分细胞具有促进EVs生成的功能。此外,细胞外间质可以限制EVs流出肿瘤组织微环境,这一作用则又可以被细胞外基质中的其他物质所拮抗,从而使EVs在肿瘤组织环境中的移动处于动态平衡中。Ti-EVs被组织环境中的靶细胞特异性捕获的过程也存在诸多未知,Ti-EVs和靶细胞表面的黏附相关蛋白可能在这个过程中发挥重要作用。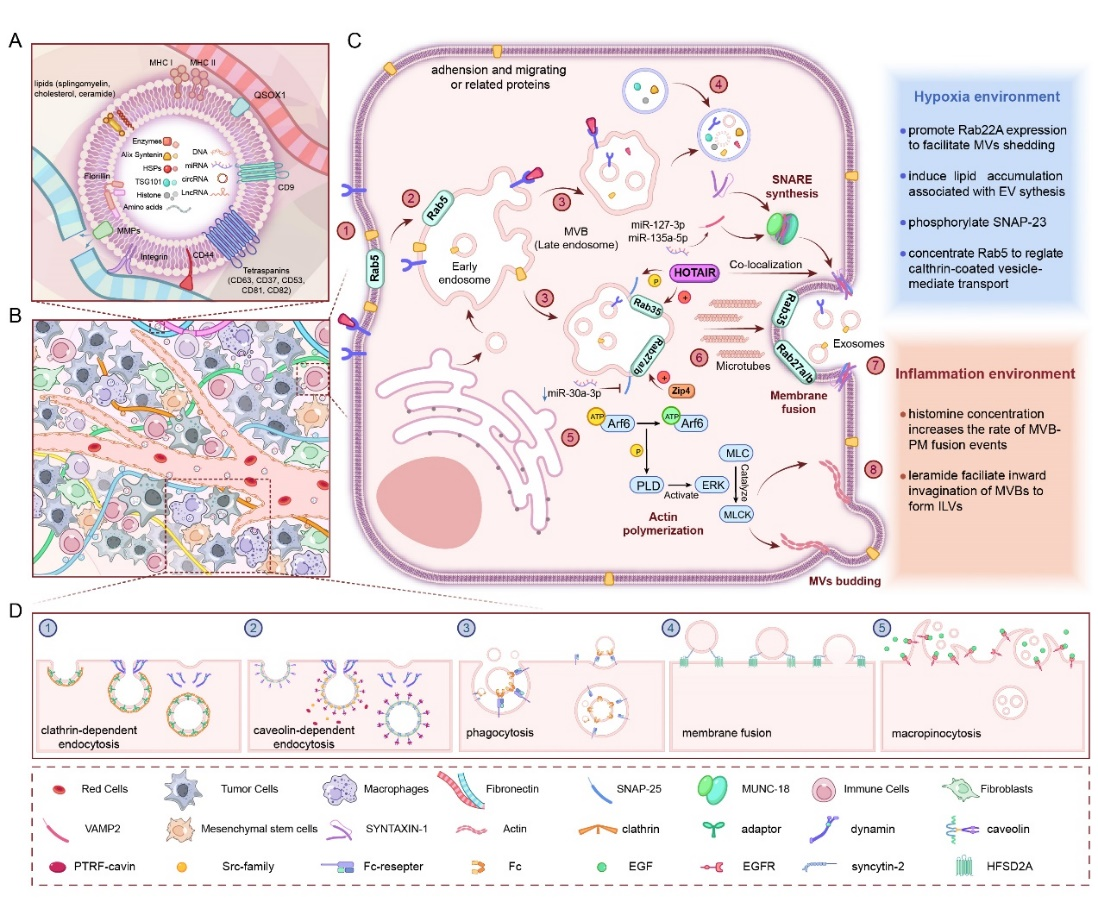
Ti-EVs肿瘤进展中起到了重要且独特的作用。具体来说,Ti-EVs负责维持肿瘤细胞的增殖信号,诱导血管生成,促进局部侵袭和远程转移,逃避免疫破坏,抵抗肿瘤细胞凋亡,以及促进药物抵抗(如图二)。这些囊泡参与了肿瘤增殖和转移的全过程,并且可能针对免疫检查点发挥免疫抑制作用。Ti-EVs还可以诱导数种血管生成相关因子,抑制内源性和外源性凋亡信号通路,从而帮助肿瘤获得更加优质的生存环境。由于Ti-EVs携带货物的复杂性,它们在促进肿瘤进展的同时,也可能具有协助肿瘤抵抗药物攻击的能力。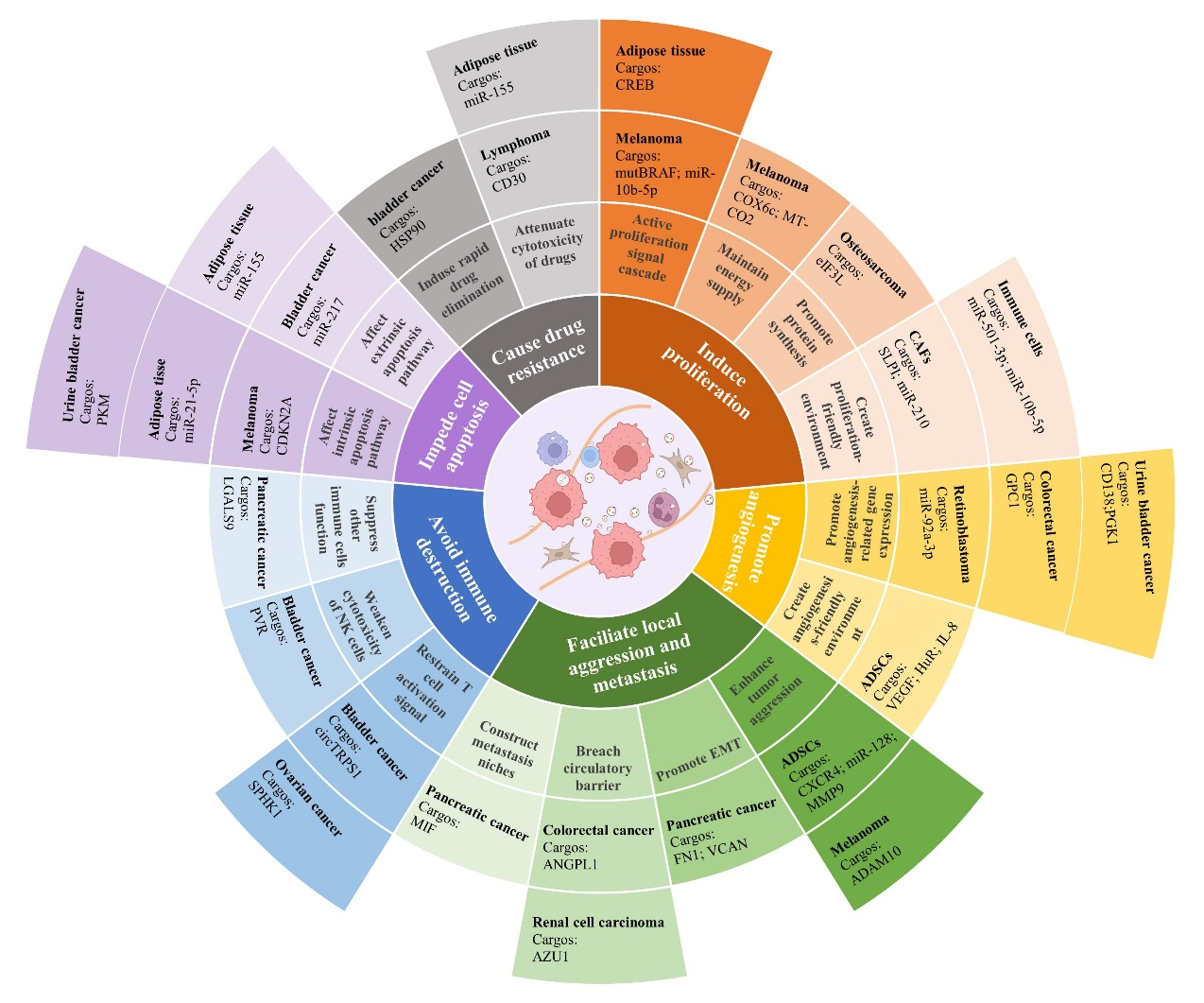
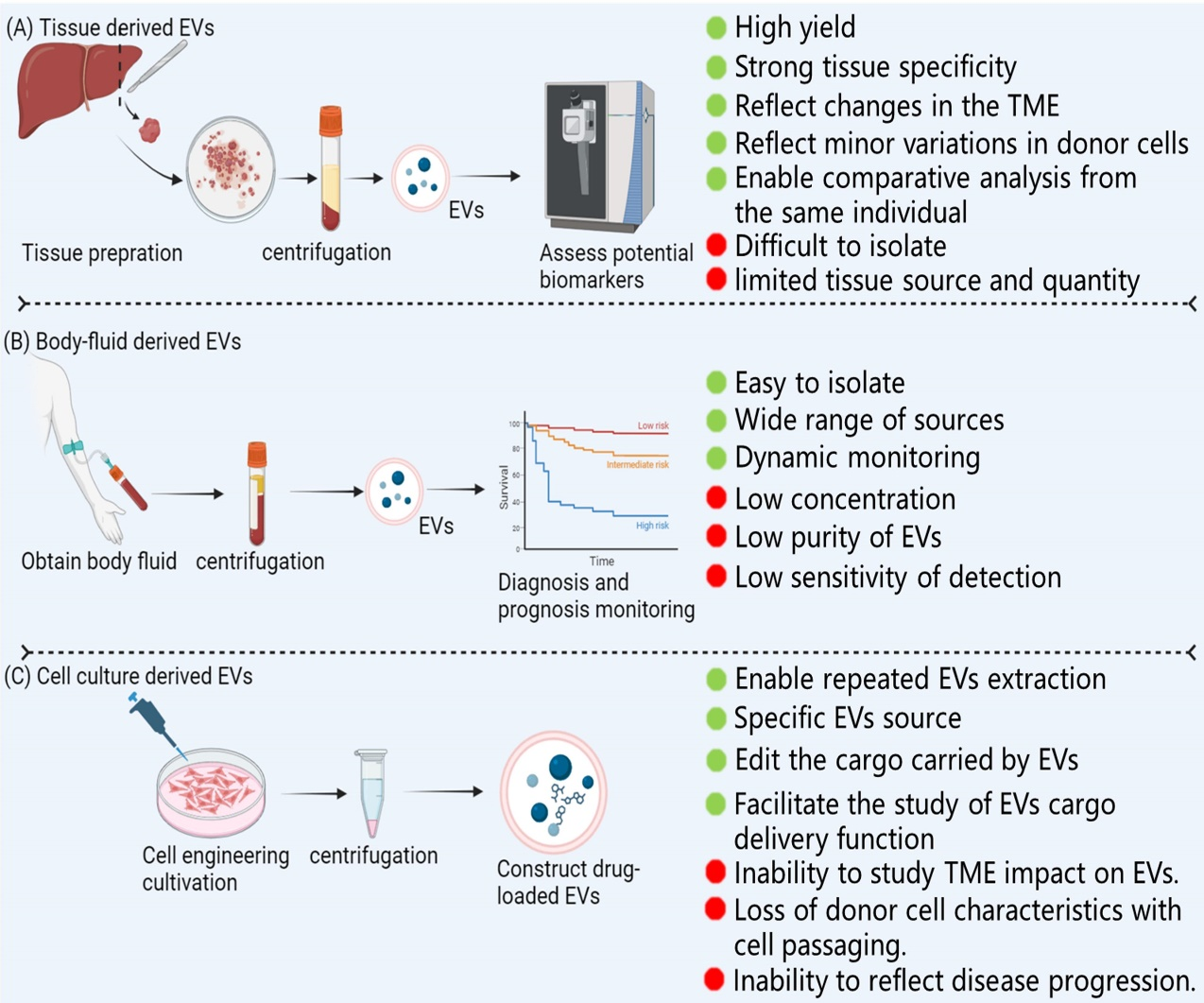
总而言之,Ti-EVs与肿瘤微环境中的多种成分具有复杂的相互作用关系。基于以往的研究,该文章总结归纳了一些Ti-EVs可能的特征:1)Ti-EVs的影响是双向的;例如,肿瘤细胞产生的外泌体可以对非肿瘤细胞产生影响,反之亦然。2)不同环境下产生的Ti-EVs对同一类型的肿瘤细胞会产生相反的作用。3)miRNA是Ti-EVs的重要功能货物,而多个miRNA货物通常产生协同作用,但偶尔也存在拮抗作用。4)由于外泌体载货量大,可以同时对肿瘤进展的多个方面产生影响。考虑到组织来源的EVs与肿瘤微环境密切相关并且参与了肿瘤进展的各个方面,Ti-EVs在临床工作中的应用可能具有巨大的潜力(如图三)。Tissue-derived extracellular vesicles in cancer progression: mechanisms, roles, and potential applications, Cancer Metastasis Rev. 2023 Oct 18. doi: 10.1007/s10555-023-10147-6.外泌体资讯网 Cancer Metastasis Rev | 四川大学华西医院雷建勇团队:癌症进展中的组织源性细胞外囊泡:机制、作用和潜在应用








