神经元通过突触的电化学传递相互沟通。中枢神经系统的驻留免疫细胞——小胶质细胞通过多种接触依赖和非接触依赖的方式调节这种通信。在炎症刺激下,小胶质细胞分泌活性唾液酸酶是一种未被探索的调节机制。来自美国斯坦福大学的研究人员发现,神经元暴露于细菌唾液酸酶会破坏神经元网络连接性,而小胶质细胞分泌细胞外囊泡传递唾液酸酶Neu3促进神经元唾液酸化,同样造成了神经元网络的异常。相关内容以“Microglia Mediate Contact-Independent Neuronal Network Remodeling via Secreted Neuraminidase-3 Associated with Extracellular Vesicles”为题发表于11月22日的国际综合性化学学术期刊ACS Central Science上。
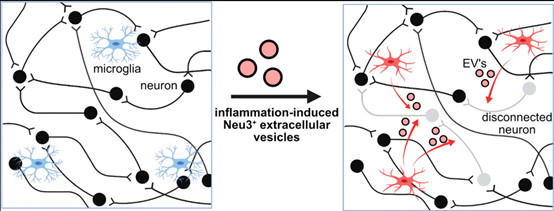
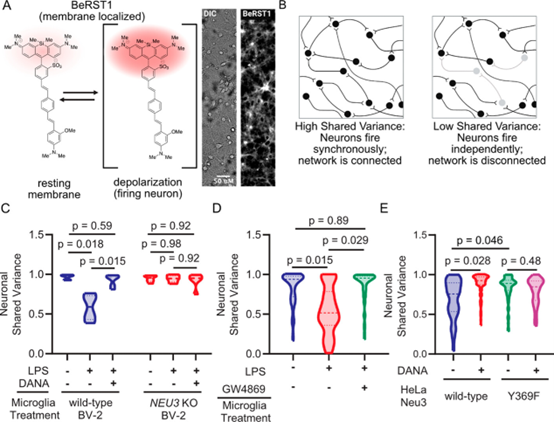
大脑由大量相互连接且相互依赖的神经元网络构成,通过突触传递信息。小胶质细胞(Microglia),是中枢神经系统中的驻留免疫噬菌细胞,通过直接和补体介导的吞噬等多种机制修剪这些突触。这些活动在神经炎症病理学条件里上调,包括阿尔茨海默病和帕金森病等疾病。然而,高度炎症性小胶质细胞介导这些效应的具体机制尚不清楚,特别是在这些行动如何影响神经元通过突触进行网络连接和通信的背景下。鉴于神经退行性疾病与异常的网络级神经活动相关,了解炎症性小胶质细胞调节神经通信的分子机制非常重要。神经炎症与神经元和小胶质细胞的糖萼(glycocalyx,细胞表面的糖覆盖物)的变化相关联。唾液酸(sialic acids)是糖萼中的一类生物活性糖的特殊类型。已知唾液酸能够调节神经元的兴奋性和可塑性,并且唾液酸的变化状态与神经炎症和小胶质细胞激活相关。在炎症刺激下,已观察到小胶质细胞释放唾液酸酶活性到周围介质中,从而导致去唾液酸作用、调节因子沉积、小胶质细胞激活和神经元吞噬。此外,研究团队此前发现唾液酸化状态是维持神经元兴奋性和网络整合的关键因素。总体而言,这些观察结果指向糖萼作为神经元活动调节因子。在这项研究里,研究人员验证了小胶质细胞释放的唾液酸酶是否能够影响非接触式神经元网络的去同步化。研究发现在炎症刺激下,小胶质细胞释放神经氨酸酶-3(Neu3),这是一种与外周膜糖脂酶相关的唾液酸酶。唾液酸的原型5-N-乙酰神经氨酸(5-N-acetylneuraminic acid)的命名是基于观察到神经元外侧叶片上唾液酸的丰富存在,尤其是称为神经苷脂的唾液酸化糖脂。Neu3是一种与细胞膜相关的糖脂酶,推测它可能在调节神经元连接性方面发挥作用。Neu3被定位于一群与神经元促融合的细胞外囊泡中。使用电压感应成像染料,研究发现Neu3既是必要的又是充分的,以介导神经元网络的断开连接。基于这些数据,研究人员提出一个假设,即小胶质细胞分泌Neu3以重塑神经元糖萼,从而调节神经元连接性。这些结果对于神经炎症导致神经元网络功能障碍具有重要意义。研究结果显示,激活的小胶质细胞分泌与促融合的细胞外囊泡相关的Neu3。此外,Neu3通过神经元糖萼重塑介导非接触性地破坏神经元网络同步性。结果显示,在炎症刺激下NEU3在转录水平上调节,并且NEU3的基因敲除消除了炎症微胶质分泌物的唾液酶活性。此外,Neu3与细胞外囊泡的亚群相关,可能是外泌体,这些细胞外囊泡在炎症刺激下由小胶质细胞分泌。最后,研究证明Neu3既使神经元去唾液酸化,又减少神经元网络连接性。这些结果说明Neu3参与糖萼的重塑,导致神经元的异常网络活动,对帕金森病和阿尔茨海默病等神经炎性疾病具有重要意义。
总的来说,这项研究呈现了一种新机制,即小胶质细胞通过细胞外囊泡分泌和转移Neu3来调节神经元唾液酸化。此外,研究展示了Neu3介导的重塑对神经元网络连接性的显著影响,为神经元网络同步性的非接触式调节途径提供了分子细节。这些发现展示了小胶质细胞和神经元之间沟通的新轴。事实上,唾液酸糖可以作为神经炎症、神经元修剪和电生理学变化之间的机制桥梁,使其成为神经系统疾病的潜在治疗靶点。这种重连的电机制以及导致此效应的其他神经炎症信号是未来研究的热点领域。参考文献:Microglia Mediate Contact-Independent Neuronal Network Remodeling via Secreted Neuraminidase-3 Associated with Extracellular Vesicles. ACS Cent Sci. 2023;9(11):2108-2114.