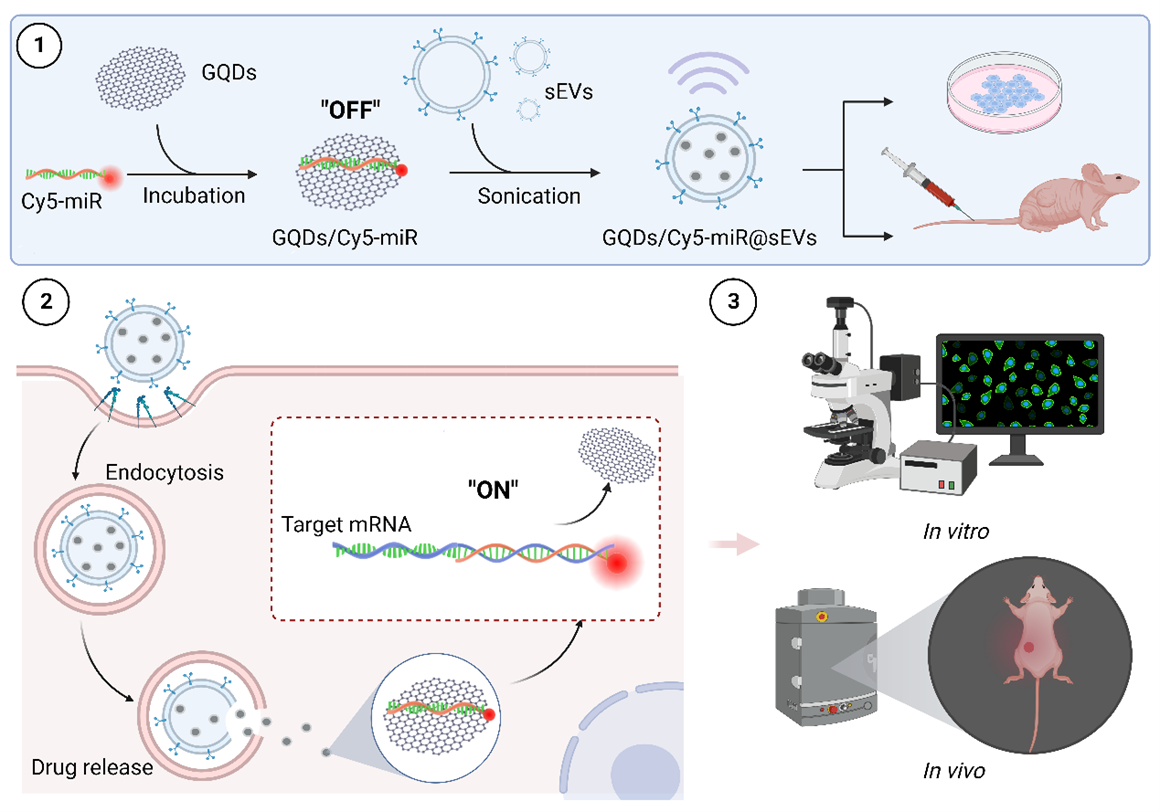
细胞外囊泡(EVs)作为新型核酸药物递送系统在疾病治疗方面已经取得了巨大进展。然而,miRNA作为新型核酸药物与其靶mRNA之间的杂交仍然很难实现在体内成像以及疗效评估。近日,江苏大学钱晖教授、许文荣教授以及陶志敏教授在国际知名学术期刊Journal of Nanobiotechnology (中科院一区,IF:10.2)上发表了题为“Visualization of microRNA therapy in cancers delivered by small extracellular vesicles”的研究论文(2023 Nov 29;21(1):457),为核酸药物miRNA在体内的可视化递送提供了一种创新的策略。
研究人员设计了一种由小细胞外囊泡(sEVs)包裹的纳米级“off-on”复合物,用于实时可视化和评估人类胃癌细胞和小鼠肿瘤模型中的基因治疗效率。该复合物是由石墨烯量子点(GQDs)和修饰荧光信号的肿瘤抑制因子miR-193a-3p之间的π–π堆叠形成的,其信号在与GQDs结合时保持不变。使用超声技术将GQDs/Cy5-miR颗粒加载到sEVs中形成GQDs/Cy5-miR@sEVs,荧光共聚焦结果显示sEVs能够促进miR-193a-3p进入肿瘤细胞并从内体中逃逸。GQDs/Cy5-miR中的miR-193a-3p在细胞中被释放与其特异性靶基因细胞周期蛋白1(CCND1)mRNA,从而开启miRNA荧光信号结合。研究发现GQDs/Cy5-miR@sEVs可以在细胞内和动物活体内均实现“off-on”荧光信号的功能,并在荷瘤小鼠体内,24h内表现出最佳的肿瘤内滞留效果,这表明在miRNA-mRNA结合的动态过程中,被GQDs/Cy5-miR@sEVs包裹递送的miR-193a-3p能最大程度进入肿瘤细胞内发挥抑制肿瘤细胞增殖、迁移和侵袭的生物学活性。在HGC胃癌小鼠模型中,研究者进一步证明了该策略的有效性,动物实验结果显示GQDs/Cy5-miR@sEVs能够显著递送更多的治疗性miR-193a-3p到达肿瘤细胞并与其靶基因结合,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,进而抑制小鼠皮下瘤生长。值得关注的是,该团队在研究过程中发现当前利用超声进行sEVs装载核酸药物的方法均为直接借鉴以往细胞超声装载药物常规参数,但由于sEVs与细胞的尺寸存在巨大差异,因此,此类超声方法可能存在装载效率低、对sEVs膜破坏性大等问题,针对此技术难点,该项目研究人员通过调节不同超声功率,探索并确定了能够成功装载GQDs/Cy5-miR并保持sEVs膜完整性的超声条件。图1. 工程化小细胞外囊泡GQDs/Cy5-miR@sEVs的制备过程及其在生物中的应用综上所述,该研究报道了一种能同时实现“药物递送与疗效监测”的双功能平台,可以通过可视化的荧光信号在体外和体内观察递送系统对miR-193a-3p的递送效率,并下调CCDN1。特别是,sEVs递送的GQDs/Cy5-miR@sEVs显示出对靶基因CCND1的巨大特异性、高血清稳定性和优异的内体逃逸能力。得益于这些内在特征和功能,GQDs/cy5-miR@sEVs有希望发展为一个癌症基因治疗和疗效监测的新平台。Visualization of microRNA therapy in cancers delivered by small extracellular vesicles, J Nanobiotechnology. 2023 Nov 29;21(1):457. doi: 10.1186/s12951-023-02187-5.外泌体资讯网 J Nanobiotechnol|江苏大学钱晖/许文荣/陶志敏:基于小细胞外囊泡的新型microRNA递送系统实现癌症治疗可视化